
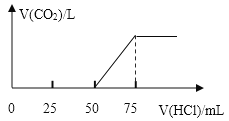
【题目】取一定物质的量浓度的 NaOH 溶液 100 mL,向其中通入一定量的 CO2 气体,得到溶液 A,向A 中逐滴缓慢加入 2.00mol/L 的 HCl 溶液,产生的 CO2 气体体积 (标准状况)与所加 HCl 溶液的体积之间关系如图所示,请回答(结果留三位有效数字):
(1)A 溶液中的溶质_________。(用化学式表示)
(2)通入的 CO2 的体积(标准状况)为______L。
(3)原 NaOH 溶液的物质的量浓度_____mol/L。
【答案】NaOH、Na2CO3 1.12 1.50
【解析】
CO2与NaOH溶液反应有如下两种“边界”情况:
CO2+2NaOH=Na2CO3+H2O…①;CO2+NaOH=NaHCO3…②;
故反应后溶液中溶质的成分可有如下四种可能:Na2CO3和NaOH、Na2CO3、Na2CO3和NaHCO3、NaHCO3;
当将稀盐酸逐滴滴到碳酸钠溶液中时,Na2CO3跟盐酸的反应是分步进行的:
Na2CO3+HCl= NaHCO3+NaCl…③
NaHCO3+HCl=NaCl+H2O+CO2↑…④
并且可以看出,当反应完全进行时,两个过程消耗HCl的量相等。
若溶液中还有氢氧化钠,则首先发生反应:NaOH+HCl=NaCl+H2O…⑤
50mL~75mL发生的反应为HCO3-+H+=H2O+CO2↑,小于50mL,说明加入盐酸50mL前发生的反应分别为H++OH-=H2O,
CO32-+H+=HCO3-,结合反应的离子方程式和质量守恒的角度解答该题。
CO2与NaOH溶液反应有如下两种“边界”情况:
CO2+2NaOH=Na2CO3+H2O…①;CO2+NaOH=NaHCO3…②;
故反应后溶液中溶质的成分可有如下四种可能:Na2CO3和NaOH、Na2CO3、Na2CO3和NaHCO3、NaHCO3;
当将稀盐酸逐滴滴到碳酸钠溶液中时,Na2CO3跟盐酸的反应是分步进行的:
Na2CO3+HCl= NaHCO3+NaCl…③
NaHCO3+HCl=NaCl+H2O+CO2↑…④
并且可以看出,当反应完全进行时,两个过程消耗HCl的量相等。
若溶液中还有氢氧化钠,则首先发生反应:NaOH+HCl=NaCl+H2O…⑤
分析题中的图象:
设反应产生CO2之前消耗盐酸的体积为V1,从开始产生CO2至反应结束消耗盐酸的体积为V2。
(1)V1=50mL,V2=75mL-50mL=25mL<V1,据此判断溶液中溶质的成分是Na2CO3和NaOH。
故答案为:Na2CO3和NaOH;
(2)50mL~75mL发生的反应为HCO3-+H+=H2O+CO2↑,n(HCl)=0.025L×2.00mol/L=0.05mol,
则V(CO2)=0.05mol×22.4L/mol=1.12L,
故答案为:1.12;
(3)当加入盐酸75mL时,溶液溶质为NaCl,此时n(Na+)=n(HCl)=0.075L×2.00mol/L=0.150mol,
所以n(NaOH)=0.150mol,
c(NaOH)=![]() =1.50mol/L,
=1.50mol/L,
故答案为:1.50。


科目:高中化学 来源: 题型:
【题目】将一定质量的镁铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3 mol·L-1 NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是( )
A. 加入合金的质量不可能为6.4 g
B. 参加反应的硝酸的物质的量为0.1 mol
C. 沉淀完全时消耗NaOH溶液的体积为150 mL
D. 溶解合金时收集到NO气体的体积在标准状况下为2.24 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某微粒的核外电子排布式为1s22s22p63s23p6,下列关于该微粒的说法正确的是( )
A.它的质子数一定是18
B.它的原子和37Cl可能互为同位数
C.它的单质一定是强还原剂
D.可以确定该微粒为Ar
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正硼酸(H3BO3)是一种片层状结构白色晶体,有与石墨相似的层状结构,受热易分解,层内的H3BO3分子通过氢键相连(如图所示),则下列有关说法中不正确的是
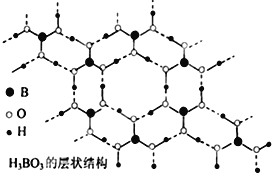
A. 正硼酸晶体属于分子晶体
B. 正硼酸分子的稳定性与氢键无关
C. 1molH3BO3晶体中含有3mol氢键
D. B原子杂化轨道的类型sp2,层间的H3BO3分子通过共价键相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列中学化学中常见物质的转化关系图中,反应条件及部分反应物和产物未全部注明,已知 A 是黑色固体单质,D 为日常生活中常见的金属单质,其它均为化合物,且 B 为有磁性的黑色固体,L 为红棕色固体。请回答下列问题:

⑴写出 C 的结构式_________
⑵写出下列物质的化学式: B:_________ E:_________
⑶写出下列反应的化学方程式或离子方程式:E→F 的化学方程式_________ G→H 的离子方程式_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素的单质和化合物在生产生活中有重要的用途。
(1)溴原子的价电子排布图为__________。
(2)在一定浓度的 HF 溶液中,氟化氢是以缔合形式(HF)2 存在的。使氟化氢分子缔合的作用力是____________。
(3)根据下表数据,分析熔点和硬度变化的原因:________________。

(4)HIO3 的酸性_____(填“>”或“<”)HIO4,原因是_________________。
(5)晶胞有两个基本要素:①坐标参数:表示晶胞内部各微粒的相对位置。下图是 CaF2 的晶胞,其中原子坐标参数 A 为(0,0,0);B 为(1/2, 1/2,0);C 为(1,1,1)。则 D 微粒的坐标参数为____。

②晶胞参数(即晶胞边长):描述晶胞的大小和形状。已知 CaF2 晶体的密度为 c gcm3,则晶胞中 Ca2+与离它最近的 F之间的距离为______nm(设 NA 为阿伏加德罗常数的值,用含 c、NA 的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是
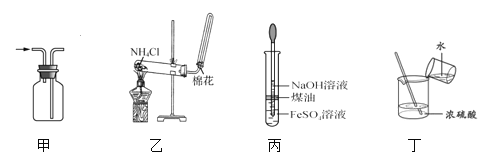
A. 用图甲所示装置收集 NO B. 用图乙所示装置制备 NH3
C. 用图丙所示装置制备 Fe(OH)2 D. 用图丁所示装置稀释浓 H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分条件已略去)。 A 为海水中含量最高的盐类物质, C 为黄绿色气体, F 为生活中常见的金属单质, I 为红褐色沉淀。
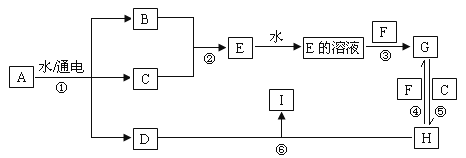
(1)E的化学式为____,I的化学式为____。
(2)写出反应①的化学方程式:____;写出反应⑤的离子方程式:____。
(3)检验 H 溶液中金属阳离子的方法是____。
(4)保存 G 溶液时要加少量固体 F 的原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】既可以鉴别乙烷和乙炔,又可以除去乙烷中含有的乙炔的方法是( )
A. 通入足量的酸性高锰酸钾溶液B. 与足量的溴水反应
C. 点燃D. 在一定条件下与氢气加成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com