
����Ŀ��PX���л���A��Ӣ����д���ǻ��������зdz���Ҫ��ԭ��֮һ���������������ϡ�������ά����Ĥ��ҩ��ȣ����о���������������ʺϳ�ijҩ���ϳ�·�����£����ַ�Ӧ�Լ����������ԣ���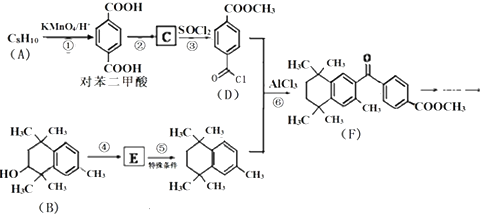
��֪���� ![]()
![]()
��RCOOH ![]()
![]()
�Իش��������⣺
��1��PX��ԭ��A�Ľṹ��ʽΪ ��
��2��F�����к��������ŵ�����Ϊ�� ��
��3����Ӧ�١��������ķ�Ӧ���ͷֱ�Ϊ�� ��
��4����Ӧ�ܵĻ�ѧ����ʽΪ ��
��5��G�ǶԱ��������ͬϵ��������ȶԱ��������14��G�ж���ͬ���칹�壬��ͬʱ��������������ͬ���칹�����֣�
a�����ڷ����廯���� b������NaHCO3��Һ��Ӧ��������c���ܷ���ˮ�ⷴӦ��������Ӧ
��6����A����ϩΪԭ�Ͽ��Ժϳ�Ŀǰ�����ϲ�����ߵĺϳ���ά����������ά���۶Ա��������Ҷ����������ϳ�·�����£�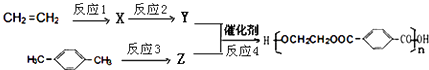
��Ӧ3���Լ�Ϊ ��
��Ӧ2�ͷ�Ӧ4�Ļ�ѧ����ʽ�ֱ�Ϊ�� ��
���𰸡�
��1��![]()
��2���ʻ�������
��3��������Ӧ��ȡ����Ӧ
��4��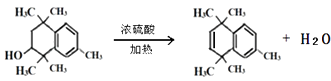
��5��17
��6������KMnO4��Һ��BrCH2CH2Br+2NaOH ![]() BrCH2CH2Br+2NaBr��
BrCH2CH2Br+2NaBr��![]()
���������⣺A�����Ը��������Һ�������ɶԱ������ᣬ��AΪ�Զ��ױ�����ṹ��ʽΪ ![]() �����ݶԱ��������D�Ľṹ��ʽ��֪CΪ
�����ݶԱ��������D�Ľṹ��ʽ��֪CΪ ![]() ���Ա�B�뷴Ӧ�ݵIJ���ṹ��֪��B������ȥ��Ӧ����EΪ
���Ա�B�뷴Ӧ�ݵIJ���ṹ��֪��B������ȥ��Ӧ����EΪ  ����Ӧ����E��H2�����ӳɷ�Ӧ����1��A�ķ���ʽΪC8H10 �� A�����Ը�����������ɵöԱ������ᣬ����AΪ�Զ��ױ����ṹ��ʽΪ��
����Ӧ����E��H2�����ӳɷ�Ӧ����1��A�ķ���ʽΪC8H10 �� A�����Ը�����������ɵöԱ������ᣬ����AΪ�Զ��ױ����ṹ��ʽΪ�� ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ����2������F�ṹ��ʽ֪��F�к���������Ϊ�ʻ������������Դ��ǣ��ʻ�����������3����Ӧ��Ϊ�Զ��ױ�������Ϊ�Ա������ᣬ��Ӧ����Ϊ������Ӧ���Աȷ�Ӧ���з�Ӧ�����Ľṹ��֪����Ӧ��Ϊȡ����Ӧ�����Դ��ǣ�������Ӧ��ȡ����Ӧ����4����Ӧ��Ϊ�ǻ�����ȥ��Ӧ����Ӧ����ʽΪ��
����2������F�ṹ��ʽ֪��F�к���������Ϊ�ʻ������������Դ��ǣ��ʻ�����������3����Ӧ��Ϊ�Զ��ױ�������Ϊ�Ա������ᣬ��Ӧ����Ϊ������Ӧ���Աȷ�Ӧ���з�Ӧ�����Ľṹ��֪����Ӧ��Ϊȡ����Ӧ�����Դ��ǣ�������Ӧ��ȡ����Ӧ����4����Ӧ��Ϊ�ǻ�����ȥ��Ӧ����Ӧ����ʽΪ�� 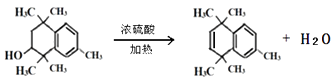 �����Դ��ǣ�
�����Դ��ǣ�  ����5��G�ǶԱ��������ͬϵ��������ȶԱ��������14����һ��CH2ԭ���ţ�G�ж���ͬ���칹�壬��ͬʱ��������������a�����ڷ����廯������б�����b������NaHCO3��Һ��Ӧ�������壬���Щ�COOH��c���ܷ���ˮ�ⷴӦ��������Ӧ������һ������Ϊ��CH��COOH��OOCH������2������Ϊ��COOH����CH2OOCH����CH2COOH����OOCH�������ڡ��䡢�����֣���������������COOH����CH3����OOCH������COOH����CH3������λʱ����OOCH��4��λ�ã�����COOH����CH3���ڼ�λʱ����OOCH��4��λ�ã�����COOH����CH3���ڶ�λʱ����OOCH��1��λ�ã��ʹ���1+6+10=17�֣����Դ��ǣ�17����6���ɾ۶Ա��������Ҷ������Ľṹ��֪�䵥��Ϊ
����5��G�ǶԱ��������ͬϵ��������ȶԱ��������14����һ��CH2ԭ���ţ�G�ж���ͬ���칹�壬��ͬʱ��������������a�����ڷ����廯������б�����b������NaHCO3��Һ��Ӧ�������壬���Щ�COOH��c���ܷ���ˮ�ⷴӦ��������Ӧ������һ������Ϊ��CH��COOH��OOCH������2������Ϊ��COOH����CH2OOCH����CH2COOH����OOCH�������ڡ��䡢�����֣���������������COOH����CH3����OOCH������COOH����CH3������λʱ����OOCH��4��λ�ã�����COOH����CH3���ڼ�λʱ����OOCH��4��λ�ã�����COOH����CH3���ڶ�λʱ����OOCH��1��λ�ã��ʹ���1+6+10=17�֣����Դ��ǣ�17����6���ɾ۶Ա��������Ҷ������Ľṹ��֪�䵥��Ϊ  ��HOCH2CH2OH���Զ��ױ���Ӧ�õ�Z����ϩϵ��ת���õ�Y����ZΪ
��HOCH2CH2OH���Զ��ױ���Ӧ�õ�Z����ϩϵ��ת���õ�Y����ZΪ  ��YΪHOCH2CH2OH���Զ��ױ������Ը��������Һ�����õ�
��YΪHOCH2CH2OH���Զ��ױ������Ը��������Һ�����õ�  ����ϩ���巢���ӳɷ�Ӧ����XΪBrCH2CH2Br��X����������ˮ��Һ�����������·�ˮ�ⷴӦ�õ��Ҷ�������Ӧ3���Լ�Ϊ������KMnO4��Һ����Ӧ2�Ļ�ѧ����ʽΪ��BrCH2CH2Br+2NaOH
����ϩ���巢���ӳɷ�Ӧ����XΪBrCH2CH2Br��X����������ˮ��Һ�����������·�ˮ�ⷴӦ�õ��Ҷ�������Ӧ3���Լ�Ϊ������KMnO4��Һ����Ӧ2�Ļ�ѧ����ʽΪ��BrCH2CH2Br+2NaOH ![]() BrCH2CH2Br+2NaBr����Ӧ4�Ļ�ѧ����ʽΪ��
BrCH2CH2Br+2NaBr����Ӧ4�Ļ�ѧ����ʽΪ�� ![]() ��
��
���Դ��ǣ�����KMnO4��Һ��BrCH2CH2Br+2NaOH ![]() BrCH2CH2Br+2NaBr��
BrCH2CH2Br+2NaBr�� ![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij100 mL���Һ�У�HNO3��H2SO4�����ʵ���Ũ�ȷֱ���0.4 mol��L��1��0.1 mol��L��1����û����Һ�м���1.92 gͭ�ۣ����ȣ�����ַ�Ӧ��(���跴Ӧǰ����Һ�������)��������Һ��Cu2�������ʵ���Ũ����(����)
A. 0.15 mol��L��1 B. 0.225 mol��L��1
C. 0.35 mol��L��1 D. 0.45 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ֲ�ͬ����������϶��γɵĻ��������NaOH��Һ��Ӧ�Ĺ��У� ��
�٩�CH3�ک�OH�۩�C6H5�ܩ�CHO�ݩ�COOH��
A.6��
B.5��
C.4��
D.3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���飨As���㷺�ֲ�����Ȼ�磬��ԭ�ӽṹʾ��ͼ�� ![]() ��
��
��1����λ��Ԫ�����ڱ����壬����̬�⻯����ȶ��Ա�NH3���ǿ������������
��2����ij�����������As2O3��As2O5 �� ����As2O5���ȶ��Բ����ͼ1д��As2O5�ֽ�ΪAs2O3���Ȼ�ѧ����ʽ�� �� 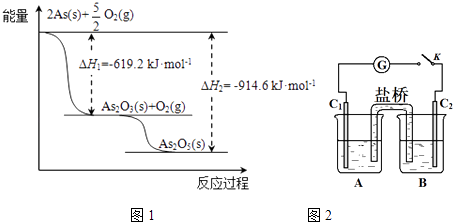
��3�������οɷ������·�Ӧ��AsO43��+2I��+2HAsO33��+I2+H2O��ͼ2װ���У�C1��C2��ʯī�缫
��A��ʢ����ɫ��KI��I2�Ļ����Һ��B��ʢ����ɫ��Na3AsO4��Na3AsO3�Ļ����Һ�������ӿ���K������B�еμ�Ũ����ʱ��������������G��ָ������ƫת����ʱC2�Ϸ����ĵ缫��Ӧ�� ��
��һ��ʱ���������ָ��ص��м䡰0��λʱ������B�еμӹ���ŨNaOH��Һ���ɹ۲쵽������ָ�������������������ƫ��������ƫ������
��4�����ã�3���з�Ӧ�ɲⶨ��As2O3��As2O5�������еĸ���ֺ������������ʶԲⶨ��Ӱ�죩���������£�
�ٽ���������NaOH��Һ���õ���AsO43����AsO33���Ļ����Һ��
As2O5��NaOH��Һ��Ӧ�����ӷ���ʽ�� ��
���������Һ��0.02500molL��1��I2��Һ�ζ�������I2��Һ20.00mL���ζ���Ϻ�ʹ��Һ�����ԣ����������KI��������I2����0.1000molL��1��Na2S2O3��Һ�ζ�������Na2S2O3��Һ30.00mL������֪2Na2S2O3+I2=Na2S4O6+2NaI��������As2O5�������� g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ��������Pt�缫����һ�����������Ʊ�����Һ�У����е�⣬ͨ��һ��ʱ��������ݳ�a mol���壬ͬʱ��w g Na2SO410H2O�������������¶Ȳ��䣬ʣ����Һ���������������ǣ� ��
A.![]() ��100%
��100%
B.![]() ��100%
��100%
C.![]() %
%
D.![]() %
%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ӣ�Ni��Cd���ɳ�������ִ��������й㷺Ӧ�ã���֪ij���ӵ�صĵ������ҺΪKOH��Һ����䡢�ŵ簴��ʽ���У�Cd+2NiOOH+2H2O ![]() Cd��OH��2+2Ni��OH��2 �� �йظõ�ص�˵����ȷ���ǣ� ��
Cd��OH��2+2Ni��OH��2 �� �йظõ�ص�˵����ȷ���ǣ� ��
A.���ʱ������Ӧ��Ni��OH��2��e��+OH���TNiOOH+H2O
B.�������ǻ�ѧ��ת��Ϊ���ܵĹ���
C.�ŵ�ʱ����������Һ�ļ��Բ���
D.�ŵ�ʱ�������Һ�е�OH���������ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ�������ɺ����������ʹ�����ǣ� ��
A.AlCl3
B.KHCO3
C.Fe2��SO4��3
D.NH4HCO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ����Ҫ�Ļ���ԭ�ϣ��������������е�Ӧ��ʮ�ֹ㷺��ij��ѧ��ȤС����ʵ�����ж�Cl2��FeCl2��KSCN�����Һ�ķ�Ӧ������̽�����ش���������:
(1)Cl2Ϊ�Ʊ�
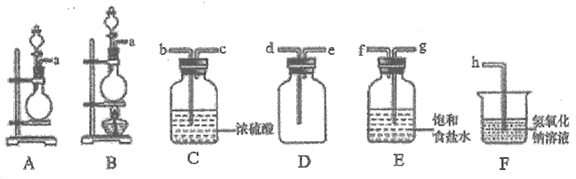
�ٸ�С��ͬѧѡ��KMnO4�����Ũ�����Ͽ����Ʊ�Cl2,���巢��װ��Ӧѡ��__(���д��ĸ)���÷�Ӧ�����ӷ���ʽΪ___________��
�����ռ�һƿ���﴿����������ѡ����ͼ�е�װ�ã�������˳��Ϊa��________(������������Сд��ĸ��ʾ)��
(2)Cl2������ʵ��
Cl2��FeCl2��KSCN�����Һ�ķ�Ӧ������Cl2����ͨ�룬Aװ������Һ�ȱ�죬������ɫ��
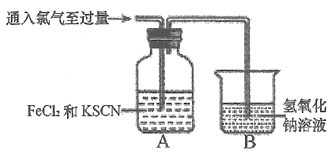
��װ��B�з�����Ӧ�����ӷ���ʽΪ___________��
��װ��A����Һ����ԭ����_________(�����ӷ���ʽ��ʾ)��
(3)����ʵ��̽��
Ϊ��̽����ͼAװ������Һ��ɫ��ȥ��ԭ��С��ȡ����A����ɫ�����Һ,�����м���_____(�ѧʽ)����Һ�ָ�Ϊ��ɫ���ɴ˵ó�����:SCN-��Cl2������
Ϊ��̽��SCN-��Cl2����������IJ�,��С������������̽��:
�ٲ������ϣ�����SCN-�е�Ԫ��Ϊ-3�ۡ�̼Ԫ��Ϊ+4�ۡ�
��ȡA����ɫ�����Һ���Թ��У������������ữ��BaCl2��Һ��������ɫ������
��ͨ��ʵ��֤����SCN-�е�Ԫ��ת��ΪNO3-��
��������ʵ��̽�����д��SCN-��Cl2��Ӧ�����ӷ���ʽΪ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W������һ������,��X+Y=Z+W,��X��Y�ķ�Ӧ��������( )
A.�κ��εķ�ӦB.�����������ˮ�ķ�Ӧ
C.�����ķ�ӦD.����������ͼ�ķ�Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com