
【题目】砷(As)广泛分布于自然界,其原子结构示意图是 ![]() .
.
(1)砷位于元素周期表中族,其气态氢化物的稳定性比NH3(填“强”或“弱”).
(2)砷的常见氧化物有As2O3和As2O5 , 其中As2O5热稳定性差.根据图1写出As2O5分解为As2O3的热化学方程式: . 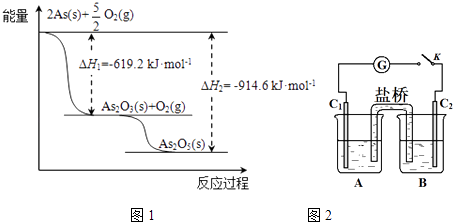
(3)砷酸盐可发生如下反应:AsO43﹣+2I﹣+2HAsO33﹣+I2+H2O.图2装置中,C1、C2是石墨电极
①A中盛有棕色的KI和I2的混合溶液,B中盛有无色的Na3AsO4和Na3AsO3的混合溶液,当连接开关K,并向B中滴加浓盐酸时发现灵敏电流计G的指针向右偏转.此时C2上发生的电极反应是 .
②一段时间后,当电流计指针回到中间“0”位时,再向B中滴加过量浓NaOH溶液,可观察到电流计指针(填“不动”、“向左偏”或“向右偏”).
(4)利用(3)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样溶于NaOH溶液,得到含AsO43﹣和AsO33﹣的混合溶液.
As2O5与NaOH溶液反应的离子方程式是 .
②上述混合液用0.02500molL﹣1的I2溶液滴定,消耗I2溶液20.00mL.滴定完毕后,使溶液呈酸性,加入过量的KI,析出的I2又用0.1000molL﹣1的Na2S2O3溶液滴定,消耗Na2S2O3溶液30.00mL.(已知2Na2S2O3+I2=Na2S4O6+2NaI)试样中As2O5的质量是 g.
【答案】
(1)ⅤA;弱
(2)As2O5(s)=As2O3(s)+O2(g)△H=+295.4 kJ?mol﹣1
(3)AsO43﹣+2H++2e﹣=AsO32﹣+H2O;向左偏
(4)As2O5+6OH﹣═2AsO43﹣+3H2O;0.115
【解析】解:(1)最外层有5个电子,则As位于第ⅤA族,由同主族位置和元素周期律可知,非金属性N>As,则As的气态氢化物的稳定性比NH3弱,所以答案是:ⅤA;弱;(2)由图象可知,As2O5分解为As2O3需要吸收的热量为﹣619kJ/mol﹣(﹣914.6kJ/mol)=+295.4 kJmol﹣1 , 则热化学方程式As2O5(s)=As2O3(s)+O2(g)△H=+295.4kJmol﹣1 ,
所以答案是:As2O5(s)=As2O3(s)+O2(g)△H=+295.4kJmol﹣1;(3)①B中滴加浓盐酸时发生AsO43﹣+2I﹣+2H+AsO33﹣+I2+H2O,A中C1棒为负极,发生2I﹣﹣2e﹣=I2 , C2为正极发生还原反应,电极反应为AsO42﹣+2H++2e﹣=AsO32﹣+H2O,所以答案是:AsO42﹣+2H++2e﹣=AsO32﹣+H2O;②向B中滴加过量浓NaOH溶液,发生AsO33﹣+I2+2OH﹣AsO43﹣+2I﹣+H2O,C2棒为负极,电子由负极流向正极,可观察到电流计指针向左偏,所以答案是:向左偏.(4)①因为As2O5为碱性氧化物,与NaOH溶液反应生成盐和水,所以离子方程式为:As2O5+6OH﹣═2AsO43﹣+3H2O,所以答案是:As2O5+6OH﹣═2AsO43﹣+3H2O;②上述混合液用0.02500molL﹣1的I2溶液滴定,消耗I2溶液20.00mL,根据AsO33﹣+I2+H2O═AsO43﹣+2I﹣+2H+反应,则消耗AsO33﹣的物质的量为0.02500molL﹣1×20.00×10﹣3L=5×10﹣4mol,新生成的AsO43﹣的物质的量也为5×10﹣4mol;设原As2O5 的物质的量:x,由As2O5→2AsO43﹣ , 则由As2O5 与氢氧化钠反应生成的AsO43﹣的物质的量为2x,后又加入过量的KI,又发生AsO42﹣+2I﹣+2H+═AsO32﹣+I2+H2O,析出的I2又用0.1000molL﹣1的Na2S2O3溶液滴定,发生反应为I2+2Na2S2O3=2NaI+Na2S4O6 , 消耗Na2S2O3溶液30.00mL,
所以有AsO43﹣~I2~2Na2S2O3
1 2
2x+5×10﹣4 0.1×30×10﹣3
解得:x=0.0005 mol
m(As2O5)=0.0005×230=0.115g
所以答案是:0.115.


科目:高中化学 来源: 题型:
【题目】按照要求填空:
(1)下面列出了几组物质,请将物质的合适组号填写在空格上. 同位素 , 同素异形体 , 同分异构体 , 同系物 .
①金刚石与“足球烯”C60;②D与T;③16O、17O和18O;④氧气(O2)与臭氧(O3);
⑤  与
与  ⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3);
⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3);
⑦ ![]() 和
和 ![]() ;⑧
;⑧ ![]() 和
和 ![]() ;
;
(2)完成离子方程式:MnO4﹣+C2O42﹣+=Mn2++CO2↑+
(3)命名有机物: ![]()
(4)写出乙酸与甲醇(CH3OH)酯化的化学方程式 .
(5)将铂丝插入KOH溶液中做电极,并在两极片上分别通入甲烷和氧气,形成一种燃料电池:通甲烷的铂丝为原电池的极,发生的电极反应为 .
(6)PET是涤纶的主要成分,可用作饮料瓶、磁带和胶片的片基等,其结构简式如图: ![]() .该高分子材料是由两种单体通过缩聚反应制备而成,其单体的结构简式为和 .
.该高分子材料是由两种单体通过缩聚反应制备而成,其单体的结构简式为和 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中的某些元素是与生命活动密不可分的元素,请回答下列问题.
(1)维生素C是一种水溶性维生素,水果和蔬菜中含量丰富,该物质结构简式如图1所示.①维生素C分子中碳原子的杂化方式有 .
②1mol维生素C分子中含有mol π键.
③维生素C分子中所含元素电负性由大到小的顺序为 .
④维生素C晶体溶于水的过程中要克服的微粒间作用力有 .
(2)KSCN溶液可用于Fe3+的检验,原因是铁离子外围有较多能量相近的空轨道,因此能与一些分子或离子形成配合物.Fe3+的价电子排布为 , 与之形成配合物的分子或离子中的配位原子应具备的结构特征是 .
(3)Fe3O4具有反尖晶石结构.某化合物MgxAlyOz与反尖晶石结构相仿,其结构如2图所示,它是由下列A、B方块组成.该化合物的化学式为 . 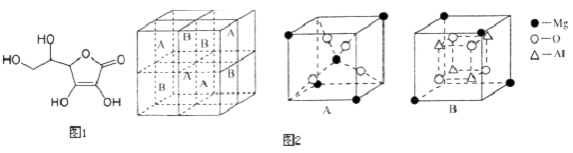
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组利用下列装置进行进行CO2与饱和Na2CO3溶液反应制备NaHCO3实验.
(1)选取必要的实验装置,正确的连接顺序为(填序号).
(2)为确定制得的固体样品是纯净的NaHCO3 小组同学提出下列实验方案:甲方案:将样品溶液与饱和澄清石灰水反应,观察现象.
乙方案:将样品溶液与BaCl2观察现象.
丙方案:测定pH法
丁方案:热重分析法
①判定甲方案(填“可行”或“不可行”);
②为判断乙方案的可行性,某同学用分析纯的NaHCO3配制的溶液,与BaCl2溶液等体积混合进行实验,结果如下. 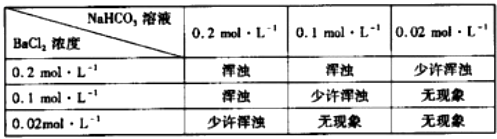
(i)此实验巳可说明乙方案是不可行的.请结合以下数据,并通过计算说明产生浑浊的原因.答: . [已知:0.1 molL﹣1 NaHC03溶液电离出的c(CO32﹣)为0.0011 molL﹣1 , Ksp(BaCO3)=5.1×10﹣9]
(ⅱ)产生浑浊的离子方程式为 .
③使用pH计进行测定的丙方案是 .
④进行丁方案实验,测得样品在不同升温速率下的热重曲线如右图.请填空:
(i)样品的纯度为 .
(ⅱ)升温速率对实验结果(填“有较大”、“有较小”或“没有”)影响.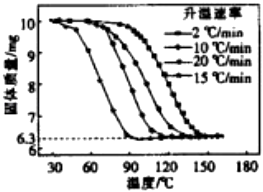
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:下列判断不正确的是( )
实验编号 | 起始浓度/(molL﹣1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
A.实验①反应后的溶液中:c(K+)>c(A﹣)>c(OH﹣)>c(H+)
B.实验①反应后的溶液中:c(OH﹣)=c(H+)+c(HA)
C.实验②反应后的溶液中:c(A﹣)+c(HA)>0.2 mol/L
D.实验②反应后的溶液中:c(K+)=c(A﹣)>c(OH﹣)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向2L的密闭容器中充入2molPCl3(g)和1molCl2(g),发生反应:PCl3(g)+Cl2(g)PCl5(g),5min达平衡,容器中的压强为开始时的 ![]() ,并且放出37.2kJ的热量,请回答下列问题:
,并且放出37.2kJ的热量,请回答下列问题:
(1)前5min内,v(Cl2)=molL﹣1min,此温度下,平衡常数K= .
(2)下列哪个图象能正确说明上述反应在进行到t1时刻时,达到平衡状态 . 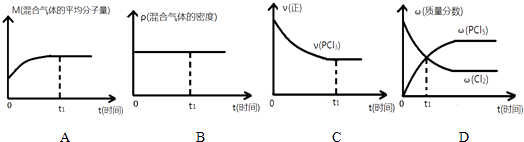
(3)平衡后,从容器中移走0.4molPCl3 , 0.2molCl2和0.2molPCl5 , 则平衡(填“正向移动”“逆向移动”或“不移动”),c(PCl3)(填“增大”“减小”或“不变”).
(4)相同条件下,若起始时,向2L的密闭容器中充入1molPCl3(g)和1molPCl5(g),反应达平衡后,理论上吸收 kJ的热量.
(5)PCl5与足量的水能完全反应生成H3PO4和HCl,将反应后的混合液逐滴加入到过量的Na2CO3溶液中,请写出可能发生反应的离子方程式 . (已知:H3PO4的电离平衡常数:Ka1=7.52×10﹣3 , Ka2=6.23×10﹣8 , Ka3=2.2×10﹣13;H2CO3的电离平衡常数:Ka1=4.3×10﹣7 , Ka2=5.61×10﹣11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PX是有机物A的英文缩写,是化工生产中非常重要的原料之一,常用于生产塑料、聚酯纤维、薄膜、药物等,有研究者设计利用其性质合成某药物,其合成路线如下(部分反应试剂和条件已略):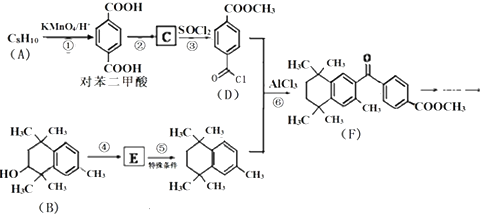
已知:Ⅰ. ![]()
![]()
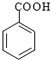
Ⅱ.RCOOH ![]()
![]()
试回答下列问题:
(1)PX即原料A的结构简式为 .
(2)F分子中含氧官能团的名称为、 .
(3)反应①、⑥所属的反应类型分别为、 .
(4)反应④的化学方程式为 .
(5)G是对苯二甲酸的同系物,分子量比对苯二甲酸大14,G有多种同分异构体,则同时符合下列条件的同分异构体有种.
a.属于芳香族化合物 b.能与NaHCO3溶液反应产生气体c.能发生水解反应和银镜反应
(6)由A和乙烯为原料可以合成目前世界上产量最高的合成纤维﹣﹣聚酯纤维(聚对苯二甲酸乙二醇酯),合成路线如下: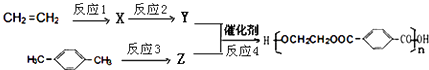
反应3的试剂为 .
反应2和反应4的化学方程式分别为、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应X(g)+3Y(g)2Z(g),若X,Y,Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X,Y,Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是( )
A.c1:c2=1:3
B.平衡时,Y和Z的生成速率之比为3:2
C.X,Y的转化率不相等
D.c1的取值范围为0<c1<0.14mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com