
【题目】常温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:下列判断不正确的是( )
实验编号 | 起始浓度/(molL﹣1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
A.实验①反应后的溶液中:c(K+)>c(A﹣)>c(OH﹣)>c(H+)
B.实验①反应后的溶液中:c(OH﹣)=c(H+)+c(HA)
C.实验②反应后的溶液中:c(A﹣)+c(HA)>0.2 mol/L
D.实验②反应后的溶液中:c(K+)=c(A﹣)>c(OH﹣)=c(H+)
【答案】C
【解析】解:A.将0.1mol/L的一元酸HA的溶液和0.1mol/L的KOH溶液等体积混合,恰好反应生成KA盐溶液,溶液的pH=9,说明溶液呈碱性,则c(OH﹣)>c(H+),HA为弱酸,溶液中A﹣离子部分水解,则:c(K+)>c(A﹣),所以溶液中离子浓度大小为c(K+)>c(A﹣)>c(OH﹣)>c(H+),故A正确;
B.0.1molL﹣1HA的溶液和0.1mol/L的KOH溶液等体积混合生成NaA和水,根据质子守恒可得:c(OH﹣)=c(H+)+c(HA),故B正确;
C.混合后溶液pH=7 常温下呈中性,则弱酸HA过量,溶液中是HA和KA的混合溶液,HA的强酸浓度大于0.2mol/L,实验②反应后的溶液中:c(A﹣)+c(HA)> ![]() mol/L=0.1 mol/L,故C错误;
mol/L=0.1 mol/L,故C错误;
D.混合后溶液pH=7,c(OH﹣)=c(H+),溶液中存在电荷守恒:c(K+)+c(H+)=c(OH﹣)+c(A﹣),所以反应后的溶液中:c(K+)=c(A﹣)>c(OH﹣)=c(H+),故D正确;
故选C.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①﹣⑧在表中的位置,用化学用语回答下列问题: 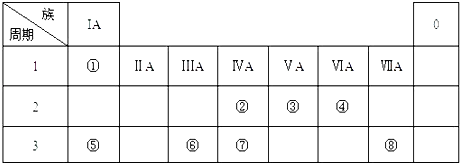
(1)④、⑤、⑥的原子半径由大到小的顺序为 .
(2)②、⑧、⑦的最高价含氧酸的酸性由强到弱的顺序是 .
(3)③的气态氢化物的电子式 .
(4)⑤的最高价氧化物对应水化物的溶液与单质⑥、单质⑧分别反应的离子方程式、 .
(5)单质①在单质⑧中燃烧,火焰为色.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】简单原子的原子结构可用下图形象地表示:
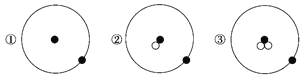
其中●表示质子或电子,○表示中子,则下列有关①②③的叙述正确的组合是( )
a.①②③互为同位素 b.①②③互为同素异形体 c.①②③是三种化学性质不同的粒子 d.①②③具有相同的质量数 e.①②③具有相同的质量 f.①②③是三种不同的原子
A. a、f B. b、c C. d、e D. e、f
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由以下五种不同基团两两结合而形成的化合物,能与NaOH溶液反应的共有( )
①﹣CH3②﹣OH③﹣C6H5④﹣CHO⑤﹣COOH.
A.6种
B.5种
C.4种
D.3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)广泛分布于自然界,其原子结构示意图是 ![]() .
.
(1)砷位于元素周期表中族,其气态氢化物的稳定性比NH3(填“强”或“弱”).
(2)砷的常见氧化物有As2O3和As2O5 , 其中As2O5热稳定性差.根据图1写出As2O5分解为As2O3的热化学方程式: . 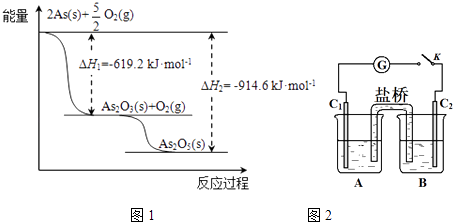
(3)砷酸盐可发生如下反应:AsO43﹣+2I﹣+2HAsO33﹣+I2+H2O.图2装置中,C1、C2是石墨电极
①A中盛有棕色的KI和I2的混合溶液,B中盛有无色的Na3AsO4和Na3AsO3的混合溶液,当连接开关K,并向B中滴加浓盐酸时发现灵敏电流计G的指针向右偏转.此时C2上发生的电极反应是 .
②一段时间后,当电流计指针回到中间“0”位时,再向B中滴加过量浓NaOH溶液,可观察到电流计指针(填“不动”、“向左偏”或“向右偏”).
(4)利用(3)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样溶于NaOH溶液,得到含AsO43﹣和AsO33﹣的混合溶液.
As2O5与NaOH溶液反应的离子方程式是 .
②上述混合液用0.02500molL﹣1的I2溶液滴定,消耗I2溶液20.00mL.滴定完毕后,使溶液呈酸性,加入过量的KI,析出的I2又用0.1000molL﹣1的Na2S2O3溶液滴定,消耗Na2S2O3溶液30.00mL.(已知2Na2S2O3+I2=Na2S4O6+2NaI)试样中As2O5的质量是 g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,将两个Pt电极插入一定量的硫酸钠饱和溶液中,进行电解,通电一段时间后,阴极逸出a mol气体,同时有w g Na2SO410H2O晶体析出,若温度不变,剩余溶液的溶质质量分数是( )
A.![]() ×100%
×100%
B.![]() ×100%
×100%
C.![]() %
%
D.![]() %
%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化钛是一种重要的工业原料.
(1)实验室可通过以下方法制得:TiCI4 ![]() TiO2xH2O
TiO2xH2O ![]() TiO2TiCl4水解生成TiO2xH2O的化学方程式是;检验TiO2xH2O中Cl﹣是否被除净的方法是 .
TiO2TiCl4水解生成TiO2xH2O的化学方程式是;检验TiO2xH2O中Cl﹣是否被除净的方法是 .
(2)工业上可用含Fe2O3的钛铁矿(主要成分为FeTiO3 , 其中Ti化合价为+4价)制取,其主要流程如下: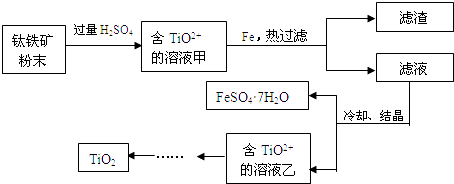
Fe2O3与硫酸反应的离子方程式是;向甲溶液中加入铁的目的是 .
(3)二氧化钛可用于制取金属钛,其步骤如下:TiO2![]() TiCl4
TiCl4![]() Ti反应②的方程式是 , 该反应需要在Ar的气氛中进行,原因是 .
Ti反应②的方程式是 , 该反应需要在Ar的气氛中进行,原因是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com