
【题目】二氧化钛是一种重要的工业原料.
(1)实验室可通过以下方法制得:TiCI4 ![]() TiO2xH2O
TiO2xH2O ![]() TiO2TiCl4水解生成TiO2xH2O的化学方程式是;检验TiO2xH2O中Cl﹣是否被除净的方法是 .
TiO2TiCl4水解生成TiO2xH2O的化学方程式是;检验TiO2xH2O中Cl﹣是否被除净的方法是 .
(2)工业上可用含Fe2O3的钛铁矿(主要成分为FeTiO3 , 其中Ti化合价为+4价)制取,其主要流程如下: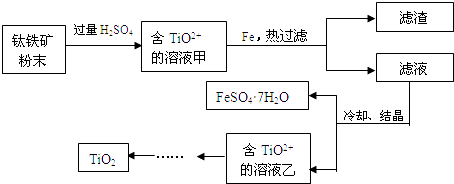
Fe2O3与硫酸反应的离子方程式是;向甲溶液中加入铁的目的是 .
(3)二氧化钛可用于制取金属钛,其步骤如下:TiO2![]() TiCl4
TiCl4![]() Ti反应②的方程式是 , 该反应需要在Ar的气氛中进行,原因是 .
Ti反应②的方程式是 , 该反应需要在Ar的气氛中进行,原因是 .
【答案】
(1)TiCl4+(x+2)H2O?TiO2?xH2O↓+4HCl;取少量水洗液,滴加硝酸酸化的AgNO3溶液,不产生白色沉淀,说明Cl﹣已洗净
(2)Fe2O3+6H+=2Fe3++3H2O;将将Fe3+转化为Fe2+
(3)TiCl4+2Mg ![]() 2MgCl2+Ti;防止高温下Mg(Ti)与空气中O2(或CO2、N2)作用
2MgCl2+Ti;防止高温下Mg(Ti)与空气中O2(或CO2、N2)作用
【解析】解:(1)TiCl4水解生成TiO2xH2O↓和HCl,反应方程式为TiCl4+(x+2)H2OTiO2xH2O↓+4HCl;氯离子和银离子反应生成白色沉淀,所以用硝酸酸化的硝酸银溶液检验氯离子,其检验方法是取少量水洗液,滴加硝酸酸化的AgNO3溶液,不产生白色沉淀,说明Cl﹣已洗净;所以答案是:TiCl4+(x+2)H2OTiO2xH2O↓+4HCl;取少量水洗液,滴加硝酸酸化的AgNO3溶液,不产生白色沉淀,说明Cl﹣已洗净;(2)氧化铁属于碱性氧化物,和稀硫酸反应生成硫酸铁和水,离子方程式为Fe2O3+6H+=2Fe3++3H2O;铁离子具有氧化性,Fe能将将Fe3+转化为Fe2+ , 从而除去杂质,所以答案是:Fe2O3+6H+=2Fe3++3H2O;将将Fe3+转化为Fe2+;(3)先将TiO2和氯气、焦炭在高温下反应生成TiCl4 , 在800℃条件下,TiCl4和Mg发生置换反应生成Ti,反应方程式为TiCl4+2Mg ![]() 2MgCl2+Ti,Mg、Ti属于较活泼金属,易和空气中氧气、氮气、二氧化碳反应,所以该反应需要在Ar的气氛中进行,所以答案是:TiCl4+2Mg
2MgCl2+Ti,Mg、Ti属于较活泼金属,易和空气中氧气、氮气、二氧化碳反应,所以该反应需要在Ar的气氛中进行,所以答案是:TiCl4+2Mg ![]() 2MgCl2+Ti;防止高温下Mg(Ti)与空气中O2(或CO2、N2)作用.
2MgCl2+Ti;防止高温下Mg(Ti)与空气中O2(或CO2、N2)作用.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】常温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:下列判断不正确的是( )
实验编号 | 起始浓度/(molL﹣1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
A.实验①反应后的溶液中:c(K+)>c(A﹣)>c(OH﹣)>c(H+)
B.实验①反应后的溶液中:c(OH﹣)=c(H+)+c(HA)
C.实验②反应后的溶液中:c(A﹣)+c(HA)>0.2 mol/L
D.实验②反应后的溶液中:c(K+)=c(A﹣)>c(OH﹣)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阴离子Xn﹣含中子N个,X的质量数为A,则ag X的氢化物中含质子的物质的量是( )
A.![]() (N﹣a)mol
(N﹣a)mol
B.![]() (n+A)mol
(n+A)mol
C.![]() (N+n)mol
(N+n)mol
D.![]() (A﹣N+n)mol
(A﹣N+n)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是

A. X、Y、Z三种元素最低价氢化物的沸点依次升高
B. 由X、Y和氢三种元素形成的化合物中只能有共价键
C. 由X、Y两种元素形成的化合物都是酸性氧化物
D. T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组对电化学问题进行了实验探究.
(1)Ⅰ.利用如图1装置探究金属的防护措施,实验现象是锌电极不断溶解,铁电极表面有气泡产生.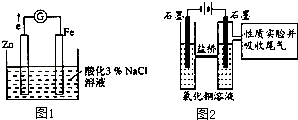
a.写出负极的电极反应式 .
b.某学生认为,铁电极可能参与反应,并对产物作出假设:
假设1:铁参与反应,被氧化生成Fe2+;
假设2:铁参与反应,被氧化生成Fe3+;
假设3: .
c.为了探究假设1、2,他采取如下操作:
①取0.01mol/L FeCl3溶液2mL于试管中,加入过量铁粉;
②取操作①试管的上层清夜加入2滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③取少量正极附近溶液加入2滴K3[Fe(CN)6]溶液,未见蓝色沉淀生成;
④取少量正极附近溶液加入2滴KSCN溶液,未见溶液变红;
据②、③、④现象得出的结论是 .
d.该实验原理可应用于防护钢铁腐蚀,请再举一例防护钢铁腐蚀的措施 .
(2)Ⅱ.利用图2装置作电解50mL 0.5mol/L的CuCl2溶液实验.实验记录:
A.阳极上有黄绿色气体产生,该气体使湿润的淀粉碘化钾试纸先变蓝后褪色;
B.电解一段时间以后,阴极表面除有铜吸附外,还出现了少量气泡和浅蓝色固体.
a.分析实验记录A中试纸颜色变化,用离子方程式解释:
①;
② .
b.分析实验记录B中浅蓝色固体可能是(写化学式),试分析生成该物质的原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“”代表一种元素,其中O点代表氢元素.下列说法中错误的是
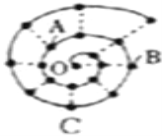
A. O与A、B、C均能形成两种化合物
B. A元素位于元素周期表ⅥA族
C. B元素是图中金属性最强的元素
D. B、C最高价氧化物的水化物可以相互反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com