
【题目】第四周期过渡元素单质及其化合物在生活、生产中有广泛应用。回答下列问题:
(1)基态Cu原子电子排布式为:__________。
(2)过渡金属单质及化合物是有机合成反应的重要催化剂。
例如:
①苯甲醇中碳原子的杂化类型是___________。
②苯甲醇的沸点比苯甲醛_______ 。(填“高”或“低”)
③苯甲醛分子中三种非金属元素C、O、H的电负性由大到小的顺序是____________ 。
(3)多数过渡金属的配离子在水中有颜色,其显色与配合物分裂能有关。定义1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量为d轨道的分裂能,用![]() 表示,中心离子电荷数越大,中心与配体距离越近,则作用越强,
表示,中心离子电荷数越大,中心与配体距离越近,则作用越强,![]() 越大。分裂能(
越大。分裂能(![]() )Co(H2O)62+_______Co(H2O)63+(填“ > ”“〈”或“ =”)。
)Co(H2O)62+_______Co(H2O)63+(填“ > ”“〈”或“ =”)。
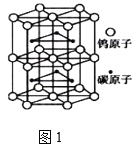
(4)钨与碳组成一种特殊材料,其晶体的晶胞如图1所示,它的熔点为2870℃、硬度类似金刚石,预测它的晶体类型是_________。
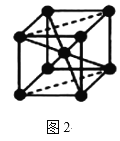
(5)Fe的一种晶体如图2所示,设阿伏加德罗常数的值为NA,铁原子的半径是r cm,该晶体的密度是ρ g/cm3,则铁的相对原子质量为___(只列出计算式)
【答案】[Ar]3d104s1 sp2、sp3 高 O>C>H < 原子晶体 ![]()
【解析】
(1)注意铜的电子排布的特殊性,保证3d轨道全满;
(2)注意苯环的碳的杂化方式与侧链上碳的杂化方式不同;醇的沸点相对偏高是因为形成了分子间氢键;电负性大小是对元素非金属性强弱的直接度量;
(3)用好题给信息中分裂能强弱的影响因素;
(4)所给晶胞不必采用均摊法分析,直接根据性质进行预测即可;
(5)采用均摊法算出每个晶胞中的铁原子数,利用密度公式求算。
(1)基态铜原子的电子排布式为:1s22s22p63s23p63d104s1或[Ar]3d104s1;
(2)①苯甲醇中苯环上的碳采取sp2杂化,侧链碳采取sp3杂化;
②由于苯甲醇能形成分子间氢键而苯甲醛不能,所以苯甲醇的沸点高于苯甲醛;
③元素的非金属性越强,电负性越大。C、O、H的电负性由大到小的顺序是O>C>H;
(3)Co(H2O)62+和Co(H2O)63+相比较,前者的中心离子电荷数小,离子半径:Co2+大于Co3+,所以前者的分裂能小;
(4)该晶体的熔点很高,硬度大,符合原子晶体的特点,故预测该晶体类型是原子晶体;
(5)在所给的铁晶胞中,与一个铁原子最近的铁原子的距离为立方体的边长的![]() ,这样的原子有8个,所以铁的配位数为8,因为铁原子的半径是rcm,根据该铁的晶胞的结构可以知道,晶胞的边长为
,这样的原子有8个,所以铁的配位数为8,因为铁原子的半径是rcm,根据该铁的晶胞的结构可以知道,晶胞的边长为![]() ,在每个晶胞中含有铁原子的数目为
,在每个晶胞中含有铁原子的数目为![]() ,设铁原子的相对原子质量为M,根据密度
,设铁原子的相对原子质量为M,根据密度![]() 可得
可得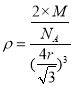 ,所以
,所以![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一种有机玻璃的结构简式为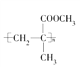 。下列关于它的叙述中不正确的是( )
。下列关于它的叙述中不正确的是( )
A. ![]() 在一定条件下发生缩聚反应即可合成该有机玻璃
在一定条件下发生缩聚反应即可合成该有机玻璃
B. 该有机玻璃能发生氧化反应
C. 合成该有机玻璃的原料可能有甲烷
D. 它在一定条件下发生水解反应时C—O键断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S是一种剧毒气体,对H2S废气资源化利用的途径之一是回收能量并得到单质硫。如图为质子膜H2S燃料电池的示意图。下列说法正确的是( )
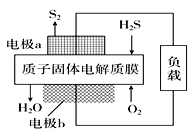
A. 电极a发生还原反应
B. 当电路中通过4 mol电子时,有4molH+经质子膜进入负极区
C. 电池总反应为:2H2S+3O2 =2SO2+2H2O
D. 电极b的电极反应式为:O2+4e-+4H+=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计及其对应的离子方程式均正确的是
A.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO![]() + 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
+ 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
B.Na2O2与H2O反应制备O2 :Na2O2 + H2O = 2Na+ + 2OH- + O2↑
C.将氯气溶于水制备次氯酸:Cl2 + H2O = 2H+ + Cl- + ClO-
D.用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+ = Cu2+ + 2Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置可用于收集SO2并验证其某些化学性质,下列说法正确的是
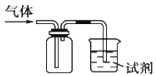
选项 | 试剂 | 现象 | 结论 |
A | 酸性高锰酸钾溶液 | 溶液褪色 | SO2有漂白性 |
B | 品红溶液 | 溶液褪色 | SO2有氧化性 |
C | 滴有酚酞的NaOH溶液 | 溶液褪色 | SO2有还原性 |
D | H2S水溶液 | 溶液变浑浊 | SO2有氧化性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有2.32 g白色沉淀,在所得的浊液中逐滴加入1 mol·L1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如下图所示,试回答:
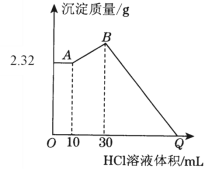
(1)B点的沉淀物的化学式为__________;写出A→B段发生反应的化学方程式_____________________________。
(2)原混合物中MgCl2的质量是________g,AlCl3的质量是________g。
(3)Q点HCl溶液加入量是________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据下列实验现象,所得结论不正确的是
实验 | 实验现象 |
| ①品红溶液红色褪去,经检验溶液中含有SO42- ②加热褪色后的溶液至沸腾,未见颜色恢复,有气体溢出,可使蓝色石蕊试纸变红,遇淀粉碘化钾试纸,无明显变化。 |
A. 品红溶液褪色是氯水漂白所致
B. 集气瓶中发生了反应:Cl2 + SO2 + 2H2O H2SO4 + 2HCl
C. 依据现象②可确定产生的气体为SO2
D. 检验SO42-的试剂为:盐酸、BaCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四川北川盛产蔷薇科植物。蔷薇科植物中含有一种芳香醛(用E表示),在染料工业和食品工业上有着广泛的用途,下面是它的一种合成路线。![]()
其中0 . l mol有机物A的质量是 12g ,在足量的氧气中充分燃烧后生成0.8mol CO2和 7.2gH2O; D 能使溴的四氯化碳溶液褪色, D 分子与 C 分子具有相同的碳原子数;F继续被氧化生成G,G 的相对分子质量为 90 。
已知:①CH3-CHO![]()
②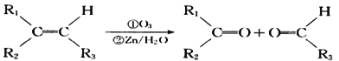
回答下列问题:
(1)A 的结构简式为__________________。
(2)A~G中能发生酯化反应的有机物有:_________(填字母序号)。
(3)C在浓硫酸加热的条件下时,分子内脱水除生成D外还可以生成另一种有机物,写出该反应的方程式:___________________;该反应类型_________。
(4)C 的同分异构体有多种,其中符合下列要求的有机物有多种。
①能与3 mol NaOH溶液反应;
②苯环上的一卤代物只有一种。
写出所有满足条件有机物的结构简式______________________________。
(5)C与4-甲基-2,3-戊二醇两分子之间1:1发生取代反应,生成的有机物有_____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表。下列判断不正确的是

A.a=6.00
B.同时改变反应温度和蔗糖的浓度,v可能不变
C.b<318.2
D.不同温度时,蔗糖浓度减少一半所需的时间相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com