
科目:高中化学 来源: 题型:阅读理解
| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (K) |
7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 |
3.0×10-8 |
 ,下列说法正确的是
,下列说法正确的是 SO2Cl2(l)△H=-97.3kJ?mol-1
SO2Cl2(l)△H=-97.3kJ?mol-1查看答案和解析>>
科目:高中化学 来源: 题型:
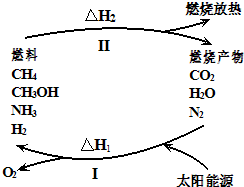 保护环境已成为当前和未来的一项全球性重大课题.为解决目前燃料使用过程中的环境污染问题,并缓解能源危机,有的专家提出利用太阳能促使燃料循环使用的构想,如图所示:
保护环境已成为当前和未来的一项全球性重大课题.为解决目前燃料使用过程中的环境污染问题,并缓解能源危机,有的专家提出利用太阳能促使燃料循环使用的构想,如图所示:
| ||
| ||
| ||
| ||
| 光能 |
| 共价键 | H-N | H-O | N≡N | O=O |
| 断裂1mol化学键所需 能量/kJ?mol-1 |
393 | 460 | 941 | 499 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河南省商丘市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
Ⅰ.电离平衡常数(用K表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
|
化学式 |
HF |
H2CO3 |
HClO |
|
电离平衡常数 (K) |
7.2×10-4 |
K1=4.4×10-7 K2=4.7×10-11 |
3.0×10-8 |
(1)物质的量浓度均为0.1mol/L的下列四种溶液:①Na2CO3溶液 ②NaHCO3溶液 ③NaF溶液 ④NaClO溶液。依据数据判断pH由大到小的顺序是______________。
(2)25℃时,在20mL0.1mol·L—1氢氟酸中加入VmL0.1mol·L—1NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_______。

A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(F-)<c(Na+)=0.1mol·L—1
(3)已知25℃时,①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH=-akJ·mol—1,
②H+(aq)+OH-(aq)=H2O(l) ΔH=-bkJ·mol—1,
氢氟酸的电离方程式及热效应可表示为________________________。
(4)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H—O—F。HFO与等物质的量的H2O反应得到HF和化合物A,则每生成1molHF转移_______mol电子。
Ⅱ.氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点–54.1℃,沸点69.1℃。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:
SO2(g)+Cl2(g) SO2Cl2(l) △H=–97.3kJ·mol—1
SO2Cl2(l) △H=–97.3kJ·mol—1
(1)试写出常温常压下化学平衡常数K的表达式:K=_________________;
(2)对上述反应,若要使化学平衡常数K增大,化学反应速率v正也增大,可采取的措施是_____(选填编号)。
a.降低温度 b.移走SO2Cl2
c.增加反应物浓度 d.无法满足上述条件
(3)下列描述中能说明上述反应已达平衡的是____________(选填编号)。
a.υ(Cl 2)=υ(SO2) b.容器中气体压强不随时间而变化
c.c(Cl 2) : c(SO2)=1:1 d.容器中气体颜色不随时间两变化
(4)300℃时,体积为1L的密闭容器中充入16.20g SO2Cl2,达到平衡时容器中含SO2 7.616g。若在上述中的平衡体系中,再加入16.20g SO2Cl2,当再次达平衡时,容器中含SO2的质量范围是________________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河南省开封市高三第二次质量检测理综化学试卷(解析版) 题型:填空题
氯气及其化合物在工农业生产和人类生活中都有着重要的应用。
(1)Ca(ClO)2、NaClO、NaClO2等含氯化合物都是常用的消毒剂和漂白剂是因为它们都具有__________性,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式____________________。
(2)棕黄色强刺激性气体Cl2O为国际公认高效安全灭菌消毒剂之一,实验室可用潮湿的Cl2与Na2CO3反应制取少量Cl2O,配平并补充完整下列反应方程式:
______Cl2+_______Na2CO3+________=_______NaHCO3+____NaCl+____ Cl2O
(3)黄色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,此反应的离子方程式为__________。
②ClO2遇浓盐酸会生成Cl2,每生成1mol Cl2转移电子的物质的量为__________。
③ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为_________________。
(4)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应4HCl+O2 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。
已知:①上述反应中,4mol HCl被氧化放出115.6kJ的热量。
②
则断开1 mol H-O键与断开1 mol H-Cl键所需能量相差约为_________kJ,H2O中
H—O键比HC1中H—Cl键(填“强”或“弱”)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知D、M、H是常见的非金属单质,其中M是无色气体,H是有色气体,J是一种金属单质(其同族的某种元素是形成化合物种类最多的元素),A、C是金属氧化物,C和J均是某种常见电池的电极材料,J元素的+2价化合物比+4价化合物稳定,B与C反应时,每生成1 mol H同时消耗4 mol B和1 mol C,K只知含有CO或CO2中的一种或两种。它们关系如图:w_w*w.k*s 5*u.c*o m
w_w w. k#s5_u.c o*m
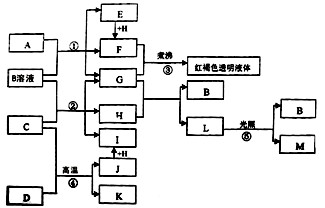
(1)写出下列物质的化学式:A D
(2)写出下列反应的化学方程式:
②
⑤
(3)由金属氧化物A和C得到其相应的金属,在冶金工业上一般可用 方法(填序号)①热分解法②热还原法 ③电解法 其中从A得到其相应金属也可用铝热法,若反应中1 mol A参加反应,转移电子的物质的量为
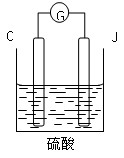
(4)用C、J作电极,与硫酸构成如下图所示电池,正极的电极反应为 当反应转移1 mol电子时,负极质量增加 gw_w*w.k*s 5*u.c*o m
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com