
【题目】三草酸合铁酸钾晶体{K3[Fe(C2O4)3]·3H2O}易溶于水,难溶于乙醇,可用于摄影和蓝色印刷.以铁屑为原料的制备流程如下:
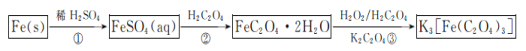
回答下列问题:
(1)流程中“①”加入的稀硫酸需稍过量,其目的是________________;若要从所得溶液中得到绿矾FeSO4·7H2O,必须进行的实验操作是________(按顺序填写)。
a.过滤洗涤 b.蒸发浓缩 c.冷却结晶 d.灼烧 e.干燥
(2)流程中“②”需过滤分离,则加入H2C2O4发生反应的化学方程式为__________。
(3)流程中“③”需控制溶液温度不高于40 ℃,理由是________________;该步反应的化学方程式为________________________;得到K3[Fe(C2O4)3]溶液后,加入乙醇,然后进行过滤,加入乙醇的理由是________________________________。
(4)所得晶体中C2O42-含量的测定可用酸性KMnO4标准溶液滴定。滴定过程中发现,开始时滴入1滴KMnO4标准溶液,紫红色褪去很慢,滴入一定量后,紫红色很快褪去,原因可能是______。
(5)三草酸合铁酸钾晶体在110 ℃可完全失去结晶水,继续升高温度可发生分解反应。
①分解得到的气体产物用如下装置进行实验:
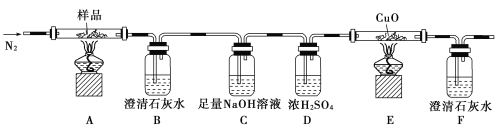
检查装置气密性后,先通一段时间的N2,其目的是____________________;结束实验时,先熄灭酒精灯再通入N2至常温。实验过程中观察到B、F中澄清石灰水都变浑浊,E中有红色固体生成,则分解得到的气体产物是______________。
②分解得到的固体产物含有K2CO3、FeO、Fe,加水溶解、过滤、洗涤、干燥,得到含铁样品。现设计下列两种实验方案对该样品进行铁元素含量测定:
(甲)
(乙)![]() 酸性KMnO4溶液V mL
酸性KMnO4溶液V mL
你认为以上________(填“甲”或“乙”)方案可确定样品的组成,测得铁元素的含量是________。
【答案】抑制Fe2+的水解 bcae FeSO4+H2C2O4+2H2O=FeC2O42H2O↓+H2SO4 防止H2O2分解 2FeC2O4·2H2O+H2O2+H2C2O4+3K2C2O4=2 K3[Fe(C2O4)3]+6H2O 三草酸合铁酸钾在乙醇中的溶解度小,有利于析出三草酸合铁酸钾晶体 生成的Mn2+起催化作用 排出装置内空气,防止干扰实验结果 CO2、CO 甲 ![]()
【解析】
由题给流程可知,铁和硫酸反应生成硫酸亚铁和氢气,反应的化学方程式为Fe+H2SO4=FeSO4+H2↑;反应生成的硫酸亚铁溶液与草酸反应生成FeC2O42H2O沉淀和硫酸,反应的化学方程式为FeSO4+H2C2O4+2H2O=FeC2O42H2O↓+H2SO4;向FeC2O42H2O沉淀中加入草酸钾、双氧水,发生氧化还原反应生成K3[Fe(C2O4)3]3H2O。
(1)FeSO4溶液中亚铁离子会水解,加酸可以抑制水解;绿矾晶体含有结晶水,则从硫酸亚铁溶液得到绿矾晶体的操作应为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故答案为防止亚铁离子水解;bcae;
(2)流程中“②”需过滤分离,说明FeC2O42H2O难溶于水,则硫酸亚铁溶液与草酸反应生成FeC2O42H2O沉淀和硫酸,反应的化学方程式为FeSO4+H2C2O4+2H2O=FeC2O42H2O↓+H2SO4,故答案为FeSO4+H2C2O4+2H2O=FeC2O42H2O↓+H2SO4;
(3)双氧水受热易分解,则控制溶液温度不高于40 ℃的目的是防止H2O2分解;向FeC2O42H2O沉淀中加入草酸钾、双氧水,发生氧化还原反应生成K3[Fe(C2O4)3]3H2O,反应的化学方程式为2FeC2O4·2H2O+H2O2+H2C2O4+3K2C2O4=2 K3[Fe(C2O4)3]+6H2O;由题意可知,三草酸合铁酸钾难溶于乙醇,加入乙醇可降低其溶解度,有利于三草酸合铁酸钾晶体析出,故答案为防止H2O2分解;2FeC2O4·2H2O+H2O2+H2C2O4+3K2C2O4=2 K3[Fe(C2O4)3]+6H2O;
(4)由开始时滴入1滴KMnO4标准溶液,紫红色褪去很慢,滴入一定量后,紫红色很快褪去,说明反应生成的硫酸锰做反应的催化剂,加快了反应速率,故答案为生成的Mn2+起催化作用;三草酸合铁酸钾在乙醇中的溶解度小,有利于析出三草酸合铁酸钾晶体;
(5)①三草酸合铁(Ⅲ)酸钾晶体在110℃可完全失去结晶水,继续升高温度可发生分解反应,根据元素守恒推测得到的产物可能是K2CO3、FeO、Fe、CO2、CO,一氧化碳还原氧化铜,得到的金属铜可被氧气氧化,所以实验开始先通一段时间N2,将装置中的空气排净,实验结束时,为防止倒吸,应该先熄灭酒精灯再通入N2至常温,实验过程中观察到B、F中澄清石灰水都变浑浊,即证明二氧化碳产生,E中有红色固体生成,证明还原性的气体一氧化碳的产生,故答案为排除装置中的空气,防止干扰实验结果; CO2、CO;
②乙方案中先是用盐酸溶解,最后加入高锰酸钾后,高锰酸钾具有氧化性,能将亚铁离子以及氯离子氧化,这样会导致得到的亚铁离子的含量偏高,干扰实验结果,无法确定样品的组成;由甲方案可知最终生成bg氧化铁,由铁原子个数守恒可知铁样品中铁元素的质量为![]() g,则含铁样品中铁元素的含量为
g,则含铁样品中铁元素的含量为![]() ,故答案为甲;
,故答案为甲;![]() 。
。


科目:高中化学 来源: 题型:
【题目】[化学—选修5:有机化学基础]
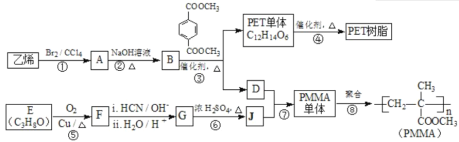
高分子材料PET聚酯树脂和PMMA的合成路线如下:
已知:Ⅰ.RCOOR′+ R′′18OH![]() RCO18O R′′+ R′OH(R、R′、R′′代表烃基);
RCO18O R′′+ R′OH(R、R′、R′′代表烃基);
Ⅱ.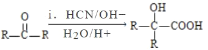 (R、R′代表烃基);
(R、R′代表烃基);
(1)①的反应类型是________。
(2)②的化学方程式为________。
(3)PMMA单体的官能团名称是________、________。
(4)F的核磁共振氢谱显示只有一组峰,⑤的化学方程式为________。
(5)G的结构简式为________。
(6)下列说法正确的是________(填字母序号)。
a.⑦为酯化反应
b.B和D互为同系物
c.D的沸点比同碳原子数的烷烃高
d.1 mol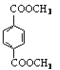 与足量NaOH溶液反应时,最多消耗4 mol NaOH
与足量NaOH溶液反应时,最多消耗4 mol NaOH
(7)J的某种同分异构体与J具有相同官能团,且为顺式结构,其结构简式是________。
(8)写出由PET单体制备PET聚酯(化学式为C10nH8nO4n 或C10n+2H8n+6O4n+2)并生成B的化学方程式________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向a L密闭容器中加入1 mol O2和2 mol NO,发生如下反应:O2(g)+2NO(g)![]() 2NO2(g),表明此反应不一定达平衡的是( )
2NO2(g),表明此反应不一定达平衡的是( )
A.容器内O2、NO、NO2的浓度之比为1∶2∶2
B.容器内压强不随时间变化
C.容器内各物质的浓度不随时间变化
D.单位时间内生成1 mol O2,同时生成2 mol NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3 L的密闭容器中,CO与H2反应生成甲醇(CH3OH)(催化剂为Cu2O/ZnO):CO(g)+2H2(g)![]() CH3OH(g)。完成下列各题:
CH3OH(g)。完成下列各题:
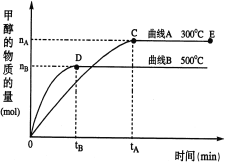
(1)反应达到平衡时,平衡常数表达式:K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,v(H2)= ;(用如图中出现的字母表示)
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是 (填序号);
a.H2的浓度减少
b.CH3OH的物质的量增加
c.正反应速率加快,逆反应速率也加快
d.重新平衡时n(H2)/n(CH3OH)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2既是温室气体,也是重要的化工原料,二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+ 2NO(g)![]() N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的浓度如下:
浓度/(mol/L)/时间/min | 0 | 10 | 20 | 30 | 40 |
NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 |
N2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
CO2 | 0 | 0.42 | 080 | 0.80 | 1.2 |
①根据图表数据分析T1℃时,该反应在0~10min内的平均反应速率v(N2)=___mol·L-1·min-1;计算该反应的平衡常数K=__。
②若30min后只改变某一条件,据上表中的数据判断改变的条件可能是__(填字母编号)。
A.加入合适的催化剂 B.适当缩小容器的体积
C.通入一定量的NO D.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:3:3,则达到新平衡时NO的转化率___(填“升高”或“降低”),△H__0(填“>”或“<”)。
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-49.1kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1kJ·mol-1
2CH3OH(g) ![]() CH3OCH3(g)+H
CH3OCH3(g)+H
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式___。
(3)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10的溶液,则溶液中c(CO32-):c(HCO3-)=__。[常温下K1(H2CO3)=4.4×10-7、K2(H2CO3)=5×10-11]。
② 欲用5L Na2CO3溶液将23.3 g BaSO4固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为_________。[已知:常温下Ksp(BaSO4)=1×10-7、Ksp(BaCO3)=2.5×10-6]。(忽略溶液体积积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按照课本实验要求,用50mL0.50mol/L的盐酸于50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热,下列说法中,正确的是( )
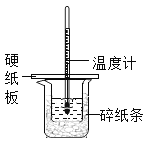
A. 烧杯间填满碎纸条的作用是固定小烧杯
B. 用如图装置可以完成中和热测定的实验
C. 为防止混合溶液时溅出产生误差,因此混合时速度要慢
D. 若将盐酸体积改为60mL,不考虑热量损失,理论上所求中和热相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确的是( )

A. NaHB溶液可能为酸性,也可能为碱性
B. A、B、C三点溶液的pH是逐渐减小,D、E、F三点溶液的pH是逐渐增大
C. E溶液中离子浓度大小关系:c(NH4+)>c(B2-)>c(OH-)>c(H+)
D. F点溶液c(NH4+)=2c(B2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关对定量实验误差分析正确的是( )
A. 中和热测定实验中,缓慢地将NaOH溶液倒入测定装置中--测定结果无影响
B. 酸碱中和滴定实验中,滴定前无气泡而滴定后有气泡_测定结果偏高
C. 测定溶液pH的实验中,用干燥pH试纸测定新制氯水的pH--测定结果无影响
D. 现需90mL 1.0molL-1NaOH溶液,称取3.6gNaOH固体配制--溶液浓度偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,常温下通电5 min后,发现铜电极的质量增加,试回答:
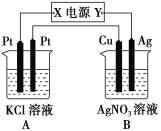
(1)电源电极X的名称为______(填“正极”或“负极”)。
(2)电解池B中阳极的电极反应式是:__________________________________________。
(3)若KCl溶液的体积是200 mL,则当铜电极的质量增加2.16 g时A中溶液的pH=________(忽略电解前后溶液体积的变化),若要使电解后的溶液恢复
到与电解前完全相同的状态,则应加入________(填物质的种类及物质的量)。
(4)当铜、银两电极的质量差为2.16 g时,A中生成的气体最多为________ mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com