
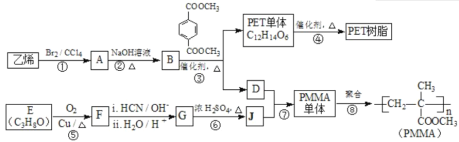
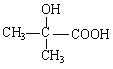
【题目】[化学—选修5:有机化学基础]
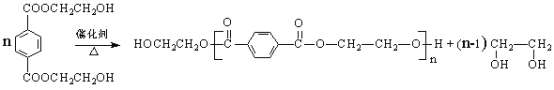
高分子材料PET聚酯树脂和PMMA的合成路线如下:
已知:Ⅰ.RCOOR′+ R′′18OH![]() RCO18O R′′+ R′OH(R、R′、R′′代表烃基);
RCO18O R′′+ R′OH(R、R′、R′′代表烃基);
Ⅱ.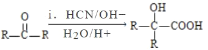 (R、R′代表烃基);
(R、R′代表烃基);
(1)①的反应类型是________。
(2)②的化学方程式为________。
(3)PMMA单体的官能团名称是________、________。
(4)F的核磁共振氢谱显示只有一组峰,⑤的化学方程式为________。
(5)G的结构简式为________。
(6)下列说法正确的是________(填字母序号)。
a.⑦为酯化反应
b.B和D互为同系物
c.D的沸点比同碳原子数的烷烃高
d.1 mol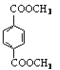 与足量NaOH溶液反应时,最多消耗4 mol NaOH
与足量NaOH溶液反应时,最多消耗4 mol NaOH
(7)J的某种同分异构体与J具有相同官能团,且为顺式结构,其结构简式是________。
(8)写出由PET单体制备PET聚酯(化学式为C10nH8nO4n 或C10n+2H8n+6O4n+2)并生成B的化学方程式________________________________________________。
【答案】加成反应  碳碳双键 酯基
碳碳双键 酯基 ![]()
 a、c
a、c 
【解析】
(1)根据合成路线可知,①为乙烯与溴的加成反应生成A为1,2-二溴乙烷;
(2)②为1,2-二溴乙烷在氢氧化钠水溶液中的水解反应生成乙二醇。化学方程式为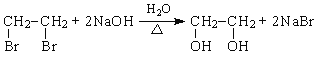 ;
;
(3)由PMMA的结构可知,PMMA为烯酯类加聚反应产物,故其单体的官能团名称是碳碳双键和酯基;
(4)F为醇催化氧化生成,其核磁共振氢谱显示只有一组峰结构对称,则E为2-丙醇,F为丙酮,故⑤的化学方程式为![]() ;
;
(5)G由丙酮在i:HCN/OH-,ii: H2O/H+作用下生成,由题目信息可知其结构简式为 ;
;
(6)a.⑦为 与甲醇发生酯化反应生成PMMA单体,故a正确;
与甲醇发生酯化反应生成PMMA单体,故a正确;
b.B为乙二醇,D为甲醇,二者不是同系物,故b错误;
c.D为甲醇,分子间可产生氢键,所以其沸点比同碳原子数的烷烃高,故c正确;
d.1 mol![]() 中含2mol酯基,所以与足量NaOH溶液反应时,最多消耗2 mol NaOH,故d错误;答案选a、c;
中含2mol酯基,所以与足量NaOH溶液反应时,最多消耗2 mol NaOH,故d错误;答案选a、c;
(7)J为2-甲基丙烯酸,其同分异构体中具有碳碳双键与羧基,且为顺式结构,其结构简式是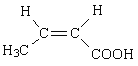 ;
;
(8)根据题干信息可知,由PET单体制备PET聚酯的化学方程式为: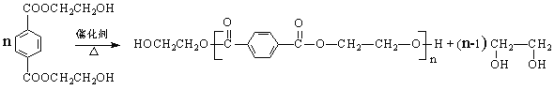 。
。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.常温下,![]() 的碱性溶液中不可能存在
的碱性溶液中不可能存在![]() 分子
分子
B.常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同
C.![]() 溶液加水稀释,溶液的pH和
溶液加水稀释,溶液的pH和![]() 的电离度均增大
的电离度均增大
D.将![]() 溶液滴入含酚酞的
溶液滴入含酚酞的![]() 溶液,红色褪去,说明
溶液,红色褪去,说明![]() 溶液显酸性
溶液显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白藜芦醇 广泛存在于食物(例如桑椹、花生,尤其是葡萄)中,它可能具有抗癌性。
广泛存在于食物(例如桑椹、花生,尤其是葡萄)中,它可能具有抗癌性。
(1)能够跟1 mol该化合物起反应的Br2或H2的最大用量分别是________。
A.1 mol,1 mol
B.3.5 mol,7 mol
C.3.5 mol,6 mol
D.6 mol,7 mol
(2)下列不能与白藜芦醇反应的是________。
A.Na2CO3溶液
B.FeCl3溶液
C.NaHCO3溶液
D.酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S水溶液中存在电离平衡:H2S![]() H++HS-和HS-
H++HS-和HS-![]() H++S2-,若向H2S溶液中( )
H++S2-,若向H2S溶液中( )
A.加入硫酸,平衡向右移动,溶液中氢离子浓度增大
B.通入过量SO2气体,溶液酸性减弱
C.通入氯气,平衡向左移动,溶液酸性增强
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备(NH4)2Fe(SO4)26H2O的实验中,需对过滤出产品的母液pH<1进行处理。室温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
A.通入过量Cl2:Fe2+、H+、NH4+、Cl-、SO42-
B.加入过量NaClO溶液:NH4+、Fe2+、H+、SO42-、ClO-
C.加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42-、OH-
D.加入过量NaClO和NaOH的混合溶液:Na+、SO42-、Cl-、ClO-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项叙述中,正确的是
A.C6H5CH2CH2OH与C6H5OH互为同系物
B.CH3CHO与CH3COOH在一定条件下均能与新制氢氧化铜反应
C.![]() 与
与![]() 互为同分异构体
互为同分异构体
D.H2O与D2O互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,用0. 100 mol·L—1盐酸滴定50. 0mL Na2CO3溶液(不考虑CO2从溶液中逸出).滴定曲线如图所示:
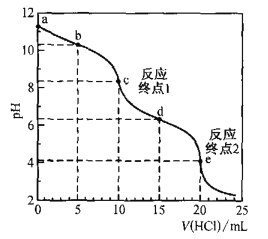
下列说法错误的是
A.a点溶液中:c(Na2CO3)=0.020 mol·L—1
B.b点溶液中:c(Na+)>c(HCO3— )>c(CO32—)
C.c点溶液中:c(Na+)+c(H+)=2c(CO32—) +c(HCO32—)+c(OH—)
D.室温时,H2CO3的一级电离平衡常数Kal的数量级为10—7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.10molL-1盐酸滴定0.10molL-1氨水,滴定过程中NH3H2O、NH4+(假设:溶液中的含氮微粒只有NH3H2O和NH4+)的物质的量分数随pH的变化关系如图所示[例如:δ(NH3H2O)=![]() ]。下列判断正确的是( )
]。下列判断正确的是( )
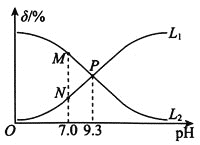
A.曲线L1代表δ(NH4+)与pH的变化关系
B.NH3H2O的电离常数Ka(NH3H2O)=1.0×10-4.7
C.水的电离程度:P>M
D.P点时混合溶液中存在:c(Cl-)=c(NH3H2O)+c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三草酸合铁酸钾晶体{K3[Fe(C2O4)3]·3H2O}易溶于水,难溶于乙醇,可用于摄影和蓝色印刷.以铁屑为原料的制备流程如下:
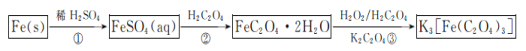
回答下列问题:
(1)流程中“①”加入的稀硫酸需稍过量,其目的是________________;若要从所得溶液中得到绿矾FeSO4·7H2O,必须进行的实验操作是________(按顺序填写)。
a.过滤洗涤 b.蒸发浓缩 c.冷却结晶 d.灼烧 e.干燥
(2)流程中“②”需过滤分离,则加入H2C2O4发生反应的化学方程式为__________。
(3)流程中“③”需控制溶液温度不高于40 ℃,理由是________________;该步反应的化学方程式为________________________;得到K3[Fe(C2O4)3]溶液后,加入乙醇,然后进行过滤,加入乙醇的理由是________________________________。
(4)所得晶体中C2O42-含量的测定可用酸性KMnO4标准溶液滴定。滴定过程中发现,开始时滴入1滴KMnO4标准溶液,紫红色褪去很慢,滴入一定量后,紫红色很快褪去,原因可能是______。
(5)三草酸合铁酸钾晶体在110 ℃可完全失去结晶水,继续升高温度可发生分解反应。
①分解得到的气体产物用如下装置进行实验:
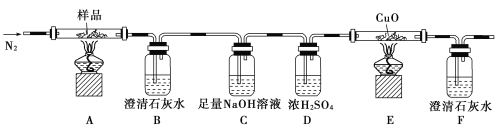
检查装置气密性后,先通一段时间的N2,其目的是____________________;结束实验时,先熄灭酒精灯再通入N2至常温。实验过程中观察到B、F中澄清石灰水都变浑浊,E中有红色固体生成,则分解得到的气体产物是______________。
②分解得到的固体产物含有K2CO3、FeO、Fe,加水溶解、过滤、洗涤、干燥,得到含铁样品。现设计下列两种实验方案对该样品进行铁元素含量测定:
(甲)
(乙)![]() 酸性KMnO4溶液V mL
酸性KMnO4溶液V mL
你认为以上________(填“甲”或“乙”)方案可确定样品的组成,测得铁元素的含量是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com