
【题目】室温下,用0.10molL-1盐酸滴定0.10molL-1氨水,滴定过程中NH3H2O、NH4+(假设:溶液中的含氮微粒只有NH3H2O和NH4+)的物质的量分数随pH的变化关系如图所示[例如:δ(NH3H2O)=![]() ]。下列判断正确的是( )
]。下列判断正确的是( )
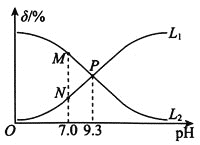
A.曲线L1代表δ(NH4+)与pH的变化关系
B.NH3H2O的电离常数Ka(NH3H2O)=1.0×10-4.7
C.水的电离程度:P>M
D.P点时混合溶液中存在:c(Cl-)=c(NH3H2O)+c(NH4+)
【答案】B
【解析】
NH3·H2O与HCl反应:NH3·H2O+HCl=NH4Cl+H2O,随着反应进行,pH逐渐减小,c(NH4+)增大,推出L2代表NH4+物质的量分数与pH的关系,L1代表NH3·H2O的物质的量分数与pH的关系,据此分析;
A. pH越小,![]() 含量越大,结合图像分析可知曲线
含量越大,结合图像分析可知曲线![]() 代表
代表![]() 与pH的变化关系,故A错误;
与pH的变化关系,故A错误;
B. 根据P点数据分析可知P点铵根离子浓度等于一水合氨的浓度,氢氧根离子浓度为![]() ,所以
,所以![]() 的电离常数
的电离常数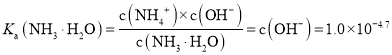 ,故B正确;
,故B正确;
C. M点相对于P点,铵离子含量前者大,所以对水的电离促进程度大,所以水的电离程度:![]() ,故C错误;
,故C错误;
D. 根据题目信息可知P点的溶液中含有等量的氯化铵和一水合氨,所以c(Cl-)<c(NH3·H2O)+c(NH4+),故D错误。
答案:B。


科目:高中化学 来源: 题型:
【题目】室温下,某实验小组探究等量且表面积相同的镁条与硫酸铜溶液的反应。(注:反应前镁条用砂纸打磨除去表面氧化膜且镁条过量)
实验 | 操作 | 实验现象 |
Ⅰ | 4mL 0.1mol/LCuSO4溶液(pH约为4.2)
| 1.有无色无味气体生成 2.镁条表面逐渐生成大量黑褐色膨松状不溶物 3.反应一段时间后,溶液逐渐变浑浊,有蓝绿色沉淀生成 |
Ⅱ |
4mL 0.5mol/LCuSO4溶液(pH约为3.6) | 1.有大量无色无味气体生成 2.镁条表面逐渐生成红褐色不溶物 3.反应一段时间后,溶液中逐渐有蓝绿色沉淀生成,镁条上红褐色物质脱落,有光亮的红色物质生成 |
Ⅲ |
| 开始无明显现象,一段时间后产生微量无色无味气体 |
(1)实验Ⅰ中生成的无色无味气体的主要成分是________,产生原因是_________(用简单文字和离子方程式表示)。设计实验Ⅲ的目的是________。
(2)为了探究实验Ⅰ中黑褐色不溶物的成分,做实验Ⅳ。
实验 | 操作 | 实验现象 |
Ⅳ |
| 1.加入浓盐酸后,沉淀部分溶解。溶液为黄色 2.多次洗涤后的残余固体加入浓硝酸,有大量红棕色气体生成,溶液变为蓝色 |
查阅资料:Cu2O可溶于浓盐酸,得到黄色溶液。
经检测,黑褐色不溶物中含有Cu2O,请解释Cu2O产生的可能原因_________。由实验Ⅳ可以推测,黑褐色不溶物中还含有_______。残余固体加入浓硝酸时,反应的化学方程式是________。
(3)经X射线检测,蓝绿色沉淀中含Cu2+、SO42-、OH—。小组同学查阅资料:碱式硫酸铜(Cu2(OH)2SO4)是一种绿色晶体,在水中溶解度极小,能溶于稀酸和氨水。据此对沉淀成分提出两种假设:
i.是(Cu2(OH)2SO4);
ii.是Cu(OH)2和(Cu2(OH)2SO4)的混合。
经检验,最终确定蓝绿色沉淀的成分是碱式硫酸铜。请设计实验证明假设i成立________。
(4)根据上述实验推断,镁与硫酸铜溶液产物的生成与__________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修5:有机化学基础]
高分子材料PET聚酯树脂和PMMA的合成路线如下:
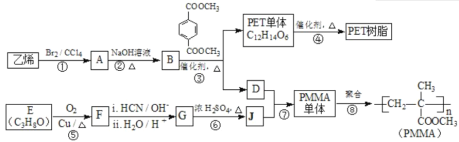
已知:Ⅰ.RCOOR′+ R′′18OH![]() RCO18O R′′+ R′OH(R、R′、R′′代表烃基);
RCO18O R′′+ R′OH(R、R′、R′′代表烃基);
Ⅱ.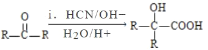 (R、R′代表烃基);
(R、R′代表烃基);
(1)①的反应类型是________。
(2)②的化学方程式为________。
(3)PMMA单体的官能团名称是________、________。
(4)F的核磁共振氢谱显示只有一组峰,⑤的化学方程式为________。
(5)G的结构简式为________。
(6)下列说法正确的是________(填字母序号)。
a.⑦为酯化反应
b.B和D互为同系物
c.D的沸点比同碳原子数的烷烃高
d.1 mol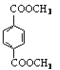 与足量NaOH溶液反应时,最多消耗4 mol NaOH
与足量NaOH溶液反应时,最多消耗4 mol NaOH
(7)J的某种同分异构体与J具有相同官能团,且为顺式结构,其结构简式是________。
(8)写出由PET单体制备PET聚酯(化学式为C10nH8nO4n 或C10n+2H8n+6O4n+2)并生成B的化学方程式________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00mL0.1000molL-1(NH4)2SO4溶液中逐滴加入0.2000molL-1NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发)。下列说法正确的是( )
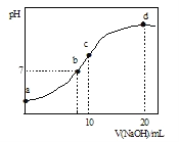
A.点a所示溶液中:c(NH4+)>c(SO42-)>c(OH-)>c(H+)
B.点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-)
C.点c所示溶液中:c(SO42-)+c(H+)=c(NH3H2O)+c(OH-)
D.点d所示溶液中:c(SO42-)>c(NH3H2O)>c(NH4+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是现行中学化学教科书中元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答问题:
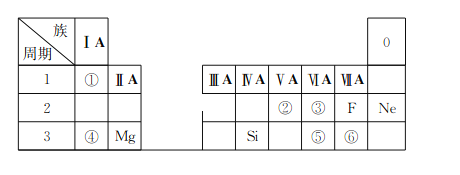
(1)①表示的元素是__________(填元素符号);
(2)②、③两种元素相比较,原子半径较小的是__________(填元素符号);
(3)写出①与⑥两种元素所形成化合物的化学式__________;
(4)③和⑤两种元素的非金属性强弱顺序是③______(填“<”或“>”)⑤;
(5)④和⑥形成化合物的电子式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同温度下,水溶液中c(H+)与c(OH-)的关系如图所示。下列有关说法不正确的是( )
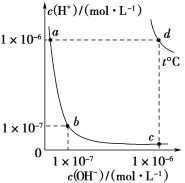
A.d点对应的食盐水pH=6,呈中性
B.a点对应的稀硫酸与c点对应的CH3COONa溶液中水的电离程度相同
C.温度为t ℃时,0.05 mol·L-1 Ba(OH)2溶液的pH=11
D.向a点对应的CH3COOH溶液中滴加NaOH溶液至b点,此时c(Na+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向a L密闭容器中加入1 mol O2和2 mol NO,发生如下反应:O2(g)+2NO(g)![]() 2NO2(g),表明此反应不一定达平衡的是( )
2NO2(g),表明此反应不一定达平衡的是( )
A.容器内O2、NO、NO2的浓度之比为1∶2∶2
B.容器内压强不随时间变化
C.容器内各物质的浓度不随时间变化
D.单位时间内生成1 mol O2,同时生成2 mol NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3 L的密闭容器中,CO与H2反应生成甲醇(CH3OH)(催化剂为Cu2O/ZnO):CO(g)+2H2(g)![]() CH3OH(g)。完成下列各题:
CH3OH(g)。完成下列各题:
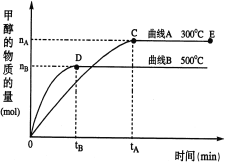
(1)反应达到平衡时,平衡常数表达式:K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,v(H2)= ;(用如图中出现的字母表示)
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是 (填序号);
a.H2的浓度减少
b.CH3OH的物质的量增加
c.正反应速率加快,逆反应速率也加快
d.重新平衡时n(H2)/n(CH3OH)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关对定量实验误差分析正确的是( )
A. 中和热测定实验中,缓慢地将NaOH溶液倒入测定装置中--测定结果无影响
B. 酸碱中和滴定实验中,滴定前无气泡而滴定后有气泡_测定结果偏高
C. 测定溶液pH的实验中,用干燥pH试纸测定新制氯水的pH--测定结果无影响
D. 现需90mL 1.0molL-1NaOH溶液,称取3.6gNaOH固体配制--溶液浓度偏低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com