
【题目】下表是现行中学化学教科书中元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答问题:
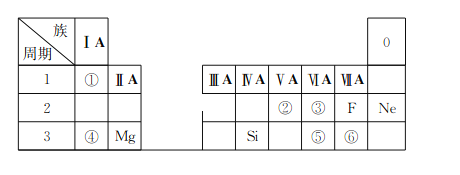
(1)①表示的元素是__________(填元素符号);
(2)②、③两种元素相比较,原子半径较小的是__________(填元素符号);
(3)写出①与⑥两种元素所形成化合物的化学式__________;
(4)③和⑤两种元素的非金属性强弱顺序是③______(填“<”或“>”)⑤;
(5)④和⑥形成化合物的电子式为________。
【答案】H O HCl > ![]()
【解析】
根据元素在周期表中的位置分析元素的种类;根据元素周期律比较原子的半径,元素的非金属性强弱;根据化合物的类型分析书写电子式。
(1)①在元素周期表中处于第1周期第IA族,原子序数为1,则表示的元素是H,故答案为:H;
(2)根据②、③两种元素在元素周期表中的位置可知,分别为N、O元素,同周期主族元素,核电荷越大,原子半径越小,则原子半径较小的是O,故答案为:O;
(3)①为H,⑥为Cl,则两种元素所形成化合物的化学式为HCl,故答案为:HCl;
(4)③为O,⑤为S,两种元素同主族,同主族元素随核电荷增大,非金属性减弱,则非金属性强弱顺序是③>⑤,故答案为:>;
(5)④为Na,⑥为Cl,形成的化合物NaCl为离子化合物,其电子式为![]() ,故答案为:
,故答案为:![]() 。
。


 小学教材全测系列答案
小学教材全测系列答案科目:高中化学 来源: 题型:
【题目】在2 L的密闭容器中充入2 molX(g)和1 mol Y(g),发生反应2X(g) +Y(g) ![]() 3Z(g) △H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示,下列推断正确的是
3Z(g) △H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示,下列推断正确的是

A.升高温度.平衡常数增大
B.W点Y的正反应速率等于M点Y的正反应速率
C.Q点时,Y的转化率最大
D.平衡时充入3molZ,达到新平衡时Z的体积分数比原平衡时大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备(NH4)2Fe(SO4)26H2O的实验中,需对过滤出产品的母液pH<1进行处理。室温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
A.通入过量Cl2:Fe2+、H+、NH4+、Cl-、SO42-
B.加入过量NaClO溶液:NH4+、Fe2+、H+、SO42-、ClO-
C.加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42-、OH-
D.加入过量NaClO和NaOH的混合溶液:Na+、SO42-、Cl-、ClO-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,用0. 100 mol·L—1盐酸滴定50. 0mL Na2CO3溶液(不考虑CO2从溶液中逸出).滴定曲线如图所示:
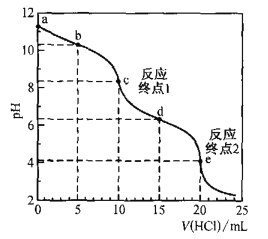
下列说法错误的是
A.a点溶液中:c(Na2CO3)=0.020 mol·L—1
B.b点溶液中:c(Na+)>c(HCO3— )>c(CO32—)
C.c点溶液中:c(Na+)+c(H+)=2c(CO32—) +c(HCO32—)+c(OH—)
D.室温时,H2CO3的一级电离平衡常数Kal的数量级为10—7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】F、G为两种常用的塑料,可经下列路线制取:

请回答下列问题:
(1)F的分子式为______,化合物C中所含官能团的名称是______、_______。
(2)写出下列反应过程的反应类型:丙烯→F________;A→B_________。
(3)1molA与2molNaOH反应发生消去反应的化学方程式为________________;B转化为C的化学方程式为______________________________________。
(4)E的一种同分异构体M具有如下性质:①能发生银镜反应;②1mol M与足量的金属钠反应可产生1mol H2,则M的结构简式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.10molL-1盐酸滴定0.10molL-1氨水,滴定过程中NH3H2O、NH4+(假设:溶液中的含氮微粒只有NH3H2O和NH4+)的物质的量分数随pH的变化关系如图所示[例如:δ(NH3H2O)=![]() ]。下列判断正确的是( )
]。下列判断正确的是( )
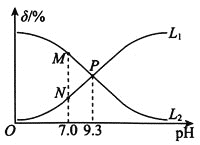
A.曲线L1代表δ(NH4+)与pH的变化关系
B.NH3H2O的电离常数Ka(NH3H2O)=1.0×10-4.7
C.水的电离程度:P>M
D.P点时混合溶液中存在:c(Cl-)=c(NH3H2O)+c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用N2O4通过电解法制备N2O5,反应方程式为N2O4+2HNO3=2N2O5+H2↑,工作原理如图所示,下列叙述正确的是
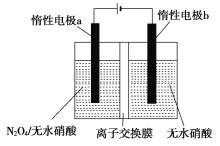
A.惰性电极a上发生还原反应
B.离子交换膜为阴离子交换膜
C.阳极区反应式为N2O4+2HNO3-2e-=2N2O5+2H+
D.反应时质子由右向左移动通过隔膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论正确的是( )
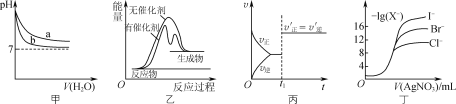
A. 图甲表示pH相同的NaOH溶液与氨水稀释过程pH的变化,曲线a对应氨水
B. 图乙表示某放热反应分别在有、无催化剂的情况下,反应过程中的能量变化
C. 图丙表示CO(g)+Cl2(g)![]() COCl2(g)的反应速率随时间的变化,在t1时改变的条件是加入催化剂
COCl2(g)的反应速率随时间的变化,在t1时改变的条件是加入催化剂
D. 图丁表示用0.0100mol·L-1的硝酸银标准溶液滴定浓度均为0.1000mol·L-1 Cl-、Br-及I-的混合溶液时,先沉淀的是Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用工业大理石(含有少量SiO2、Al2O3、Fe2O3等杂质)制取CaCl2·6H2O,设计了如下流程:

下列说法不正确的是
A. 固体I中含有SiO2,固体II中含有Fe(OH)3
B. 使用石灰水时,要控制pH,防止固体II中Al(OH)3转化为AlO2-
C. 试剂a选用盐酸,从溶液III得到CaCl2·6H2O产品的过程中,须控制条件防止其分解
D. 若改变实验方案,在溶液I中直接加氨水至沉淀完全,滤去沉淀,其溶液经蒸发浓缩、冷却结晶也可得到纯净CaCl2·6H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com