
【题目】制备(NH4)2Fe(SO4)26H2O的实验中,需对过滤出产品的母液pH<1进行处理。室温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
A.通入过量Cl2:Fe2+、H+、NH4+、Cl-、SO42-
B.加入过量NaClO溶液:NH4+、Fe2+、H+、SO42-、ClO-
C.加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42-、OH-
D.加入过量NaClO和NaOH的混合溶液:Na+、SO42-、Cl-、ClO-、OH-
科目:高中化学 来源: 题型:
【题目】配制960 mL 0.3mol/L NaOH溶液。具体如下:
(1)需称取_________g NaOH。
(2)配制过程中除烧杯、托盘天平、玻璃棒,还需要用到主要玻璃仪器是__________。
(3)下列操作会使配制的溶液浓度偏低的是___________(填字母)。
A、配制氢氧化钠溶液时,称取已吸潮的氢氧化钠固体
B、配制氢氧化钠溶液时,容量瓶中有少量水
C、发现溶液液面超过刻度线,用吸管吸出少量水,使液面降至刻度线
D、定容时俯视容量瓶刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 四种元素原子的核电荷数依次增大,它们的简单离子的电子层数相同且最外层电子数均为8,
四种元素原子的核电荷数依次增大,它们的简单离子的电子层数相同且最外层电子数均为8,![]() 元素原子的
元素原子的![]() 层电子数与
层电子数与![]() 、
、![]() 层电子数之和相等,
层电子数之和相等,![]() 元素原子的
元素原子的![]() 、
、![]() 层电子数之和等于电子总数的一半。试回答下列问题。
层电子数之和等于电子总数的一半。试回答下列问题。
(1)四种元素的符号依次是![]() ______,
______,![]() ______,
______,![]() ______,
______,![]() ______;它们的原子半径由大到小的顺序是______(用元素符号表示)。
______;它们的原子半径由大到小的顺序是______(用元素符号表示)。
(2)试写出四种元素的离子结构示意图:![]() ______,
______,![]() ______,
______,![]() ______,
______,![]() ______。它们的离子半径由大到小的顺序是______(用离子符号表示)。
______。它们的离子半径由大到小的顺序是______(用离子符号表示)。
(3)分别写出四种元素的最高价氧化物对应水化物的化学式:______。
(4)分别写出![]() 、
、![]() 两元素的气态氢化物的化学式:______。
两元素的气态氢化物的化学式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验兴趣小组利用下列实验装置探究氯气与过量氨气反应的实验,有关说法不正确的是
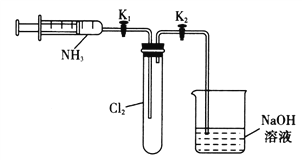
A. 打开K1,关闭K2,将注射器的活塞往外拉一小段,然后松开,活塞复原,说明装置气密性良好
B. 打开K1,推动注射器的活塞使过量的氨气与氯气混合时,产生大量的白色烟雾
C. 充分反应后,关闭K1,打开K2,可观察到烧杯中的溶液会倒吸至试管内
D. 实验室制备氨气和氯气可以用同一套发生装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
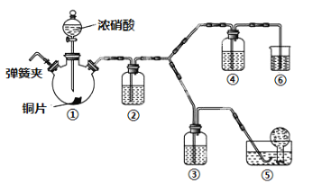
可选药品:浓硝酸、稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳。
已知:氢氧化钠溶液不与NO反应,能与NO2反应。2NO2+2NaOH=NaNO3+NaNO2+H2O
(1)实验应避免有害气体排放到空气中。装置③④⑥中盛放的药品依次是____、____、_______。
(2)滴加浓硝酸之前的一系列操作依次是检验装置的气密性,加入药品,打开弹簧夹后______。
(3)装置①中发生反应的化学方程式是___________。
(5)该小组得出的结论所依据的实验现象是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可通过反应:3Cl2+6KOH![]() 5KCl+KC1O3+3H2O 制取KC1O3,再用稍潮湿KC1O3和草酸(H2C2O4) 在60℃时反应制取ClO2气体,装置如图所示。ClO2是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。
5KCl+KC1O3+3H2O 制取KC1O3,再用稍潮湿KC1O3和草酸(H2C2O4) 在60℃时反应制取ClO2气体,装置如图所示。ClO2是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。
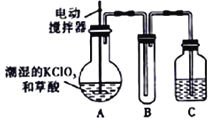
请回答下列问题:
(1)A 中反应的主要产物有:某种正盐、ClO2和CO2等,写出该反应的化学方程式:_____。
(2)请分析装置图,进行补充和完善。A部分缺________装置,B部分还应补充_______装置,还有一处设计明显不合理的是___________(填“A”“B”或“C”)。
(3)C中的试剂为NaOH溶液时,反应生成NaClO3和NaClO2,写出该反应的离子方程式____。
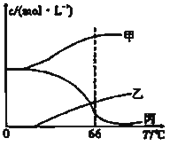
(4)在密闭容器中向9℃的KOH溶液中通入少量Cl2,此时Cl2的氧化产物主要是______;继续通入适量Cl2,将溶液加热,溶液中主要离子的浓度随温度的变化如图所示,图中甲、乙、丙依次表示的离子是__________、__________、__________(不考虑Cl2的挥发)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如图所示,下列说法正确的
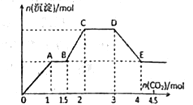
A. CD段的离子方程式可以表示为:CO32-+CO2+H2O═2HCO3-
B. 肯定不存在的离子是SO42-、OH-
C. 该溶液中能确定存在的离子是Ba2+、AlO2-、NH4+
D. OA段反应的离子方程式:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某微生物电解池(MEC)制氢工作原理如右图所示。用该电解池电解0.1mol·L-1的CH3COOH溶液,下列说法正确的是
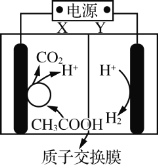
A.Y为电源的正极
B.该电解装置中,阳极的电极反应式为:CH3COOH+2H2O+8e-= 2CO2↑+8H+
C.当2mol H+通过质子交换膜时,则标准状况下产生22.4L H2
D.电解一段时间后,溶液中![]() 的值变小
的值变小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com