
����Ŀ��ijͬѧ���ù�ҵ����ʯ����������SiO2��Al2O3��Fe2O3�����ʣ���ȡCaCl2��6H2O��������������̣�

����˵������ȷ����
A. ����I���SiO2������II���Fe(OH)3
B. ʹ��ʯ��ˮʱ��Ҫ����pH����ֹ����II��Al(OH)3ת��ΪAlO2-
C. �Լ�aѡ�����ᣬ����ҺIII�õ�CaCl2��6H2O��Ʒ�Ĺ����У������������ֹ��ֽ�
D. ���ı�ʵ�鷽��������ҺI��ֱ�ӼӰ�ˮ��������ȫ����ȥ����������Һ������Ũ������ȴ�ᾧҲ�ɵõ�����CaCl2��6H2O
���𰸡�D
��������
��ҵ����ʯ����������SiO2��Al2O3��Fe2O3�����ʣ������������ᣬ�õ���������������Ȼ��ơ��Ȼ������Ȼ��������Һ�����Թ������к���SiO2����Һ�м�ʯ��ˮ������pH�����Եõ�Al(OH)3��Fe(OH)3��������Ϊ�����������ˣ�����Һ���������к������������ƣ����Ȼ�����Һ��CaCl2��6H2O�ֽ⣬����Һ�л���Ȼ��ƾ���ʱ��Ҫ��ֹ��ֽ⣻
A.��������ķ�����֪���������к���SiO2���������к���Fe(OH)3��A��ȷ��
B.���������������ԣ�����������������Һ������AlO2-��B��ȷ��
C.CaCl2��6H2O�ֽ⣬����Һ�л���Ȼ��ƾ���ʱ��Ҫ��ֹ��ֽ⣬C��ȷ��
D.���ı�ʵ�鷽��������Һ����ֱ�ӼӰ�ˮ��������ȫ����ȥ����������Һ�к����Ȼ�泥�������Ũ������ȴ�ᾧ�õ���CaCl2��6H2O������D����
��ΪD��


 ��Ӣ���㿨ϵ�д�
��Ӣ���㿨ϵ�д� Ӧ����㲦ϵ�д�
Ӧ����㲦ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���������ѧ��ѧ�̿�����Ԫ�����ڱ���һ���֣��������Ԫ���⣬���е�ÿ����ű�ʾһ��Ԫ�أ������Ҫ��ش����⣺
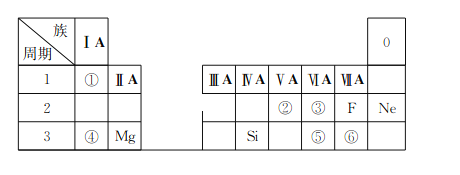
(1)�ٱ�ʾ��Ԫ����__________(��Ԫ�ط���)��
(2)�ڡ�������Ԫ����Ƚϣ�ԭ�Ӱ뾶��С����__________(��Ԫ�ط���)��
(3)д�����������Ԫ�����γɻ�����Ļ�ѧʽ__________��
(4)�ۺ͢�����Ԫ�صķǽ�����ǿ��˳���Ǣ�______(����������������)�ݣ�
(5)�ܺ͢��γɻ�����ĵ���ʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2�����������壬Ҳ����Ҫ�Ļ���ԭ�ϣ�������̼�IJ����������ҹ���Դ�����һ����Ҫս�Է���
��1���û���̿��ԭ�����Դ�������β���еĵ������ij�о�С����ij�ܱ���������һ�����Ļ���̿��NO��������ӦC(s)+ 2NO(g)![]() N2(g)+CO2(g) ��H����T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
N2(g)+CO2(g) ��H����T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
Ũ��/(mol/L)/ʱ��/min | 0 | 10 | 20 | 30 | 40 |
NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 |
N2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
CO2 | 0 | 0.42 | 080 | 0.80 | 1.2 |
�ٸ���ͼ�����ݷ���T1��ʱ���÷�Ӧ��0��10min�ڵ�ƽ����Ӧ����v(N2)��___mol��L-1��min-1������÷�Ӧ��ƽ�ⳣ��K��__��
����30min��ֻ�ı�ijһ���������ϱ��е������жϸı������������__������ĸ��ţ���
A.������ʵĴ��� B.�ʵ���С���������
C.ͨ��һ������NO D.����һ�����Ļ���̿
����30min�������¶���T2�棬�ﵽƽ��ʱ��������NO��N2��CO2��Ũ��֮��Ϊ2��3��3����ﵽ��ƽ��ʱNO��ת����___����������������������������H__0������>������<������
��2����ҵ����CO2��H2��Ӧ�ϳɶ����ѡ���֪��
CO2(g)��3H2(g) ![]() CH3OH(g)��H2O(g) ��H1����49.1kJ��mol-1
CH3OH(g)��H2O(g) ��H1����49.1kJ��mol-1
2CH3OH(g) ![]() CH3OCH3(g)��H
CH3OCH3(g)��H
д��CO2(g)��H2(g)ת��ΪCH3OCH3(g)��H2O(g)���Ȼ�ѧ����ʽ___��
��3�������£���NaOH��Һ��CO2�����������Խ���̼�ŷţ����ҿɵõ���Ҫ�Ļ�����ƷNa2CO3��
����ij�β���õ�pH=10����Һ������Һ��c(CO32��)��c(HCO3��)=__��[������K1(H2CO3)=4.4��10-7��K2(H2CO3)=5��10-11]��
�� ����5L Na2CO3��Һ��23.3 g BaSO4����ȫ��ת��ΪBaCO3�������õ�Na2CO3��Һ�����ʵ���Ũ������Ϊ_________��[��֪��������Ksp(BaSO4)=1��10-7��Ksp(BaCO3)=2.5��10-6]����������Һ������ı仯��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20mL0.05mol��L��1��ijϡ��H2B��Һ�е���0.1mol��L��1��ˮ����Һ����ˮ�����������Ũ������백ˮ����仯��ͼ�����з�����ȷ���ǣ� ��

A. NaHB��Һ����Ϊ���ԣ�Ҳ����Ϊ����
B. A��B��C������Һ��pH����С��D��E��F������Һ��pH��������
C. E��Һ������Ũ�ȴ�С��ϵ��c(NH4+)>c(B2��)>c(OH��)>c(H+)
D. F����Һc(NH4+)=2c(B2��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����û�ѧԭ�����ԶԹ����ŷŵķ�ˮ�������Ƚ�����Ч��⡣ij�������Ƹ���ҵ������Cr�����������������ù������£������Һ�н���������Ҫ��Cr3+�������Fe3+, Fe2+, Al3+, Ca2+, Mg2+��

�����²��������ӵ����������γɳ���ʱ��Һ��pH���±���
������ | Fe3+ | Fe2+ | Mg2+ | Al3+ | Ca2+ | Cr3+ |
��ʼ����ʱ��pH | 1.9 | 7.0 | 9.6 | 4.2 | 9.7 | �� |
������ȫʱ��pH | 3.2 | 9.0 | 11.1 | 8.0 | 11.7 | 9.0��>9.0�ܽ⣩ |
��1�����ʱ��Ϊ����߽�ȡ�ʿɲ�ȡ�Ĵ�ʩ��_____________________________������һ����
��2����pH=4.0��Ϊ�˳�ȥ______________________����Fe3+, Al3+, Ca2+, Mg2+��
��3�������ӽ�����֬��ԭ��ΪMn++ n NaR �� MRn+nNa+,������������������___________________________����Fe3+, Al3+, Ca2+, Mg2+��
��4������ƽ����������ԭ��Ӧ����ʽ��
____Na2Cr2O7+__SO2+____H2O =____Cr(OH)(H2O)5SO4+___Na2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йضԶ���ʵ����������ȷ����( )
A. �к��Ȳⶨʵ���У������ؽ�NaOH��Һ����ⶨװ����--�ⶨ�����Ӱ��
B. ����к͵ζ�ʵ���У��ζ�ǰ�����ݶ��ζ���������_�ⶨ���ƫ��
C. �ⶨ��ҺpH��ʵ���У��ø���pH��ֽ�ⶨ������ˮ��pH--�ⶨ�����Ӱ��
D. ����90mL 1.0molL-1NaOH��Һ����ȡ3.6gNaOH��������--��ҺŨ��ƫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�д�������ƽ�⣬�绯ѧƽ�⡢����ƽ�⡢ˮ��ƽ�⡢�ܽ�ƽ��ȵȣ���Ӧ���л�ѧƽ�ⳣ��������ƽ�ⳣ���ȡ���Ҫ��ش��������⣺
��1����ӦH2(g)+I2(g)2HI(g)��ƽ�ⳣ��ΪK1����ӦHI(g)![]() H2(g)+
H2(g)+![]() I2(g)��ƽ�ⳣ��ΪK2����K1��K2֮��Ĺ�ϵʽΪ___(ƽ�ⳣ��Ϊͬ�¶��µIJⶨֵ)
I2(g)��ƽ�ⳣ��ΪK2����K1��K2֮��Ĺ�ϵʽΪ___(ƽ�ⳣ��Ϊͬ�¶��µIJⶨֵ)
��2����������ԭ��Ϊ2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ��H<0�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�����ʾ��ͼ��ȷ��˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬����___��
2CO2(g)+N2(g) ��H<0�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�����ʾ��ͼ��ȷ��˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬����___��

��3��ij��Ԫ��(����ʽ��H2B��ʾ)��ˮ�еĵ��뷽��ʽ�ǣ�H2B=H++HB-��HB-H++B2-����0.1mol/L��Na2B��Һ�У���������Ũ�ȹ�ϵʽ��ȷ����___��
A.c(B2-)+c(HB-)=0.1mol/L B.c(B2-)+c(HB-)+c(H2B)=![]() c(Na+)
c(Na+)
C.c(OH-)=c(H+)+c(HB-) D.c(Na+)+c(OH-)=c(H+)+c(HB-)
��4���±�Ϊ������ĵ���ƽ�ⳣ��
CH3COOH | H2CO3 | H2S |
1.8��10-5 | K1=4.3��10-7 K2=5.6��10-11 | K1=9.1��10-8 K2=1.1��10-12 |
��pH��ͬ��CH3COONa��Na2CO3��NaHS��Һ���ʵ���Ũ���ɴ�С��˳��Ϊ___������CO2��NaHS��Ӧ�����ӷ���ʽΪ___��
��5��25��ʱ����0.01molL-1��MgCl2��Һ�У���μ���ŨNaOH��Һ���պó��ֳ���ʱ����Һ��pHΪ___����Mg2+��ȫ����ʱ����Һ��pHΪ___(������Һ����仯����֪25��ʱ��Ksp[Mg(OH)2]=1.8��10-11����֪lg2.4=0.4��lg7.7=0.9��
��6����֪25��ʱ��Ksp[Fe(OH)3]=2.79��10-39�����¶��·�Ӧ��Fe(OH)3+3H+Fe3++3H2O��ƽ�ⳣ��K=___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���������Ӧ�������Լ����۶���ȷ�����߾��������ϵ����
ѡ�� | ʵ�� | ���� | ���� |
A | ��1mL 0.1mol/L AgNO3��Һ�е���2��0.1 mol/L ��NaCl��Һ�����������Һ�е���2��0.1 mol/L KI��Һ������� | �Ȳ�����ɫ����������ֻ�ɫ���� | Ksp(AgCl) >Ksp (AgI) |
B | һ�������£��ܱ�������Ӧ��ƽ�⣺ H2(g)+I2(g) | ������ɫ���� | ƽ������ |
C | ���������pH��HA��HB��������Һ�ֱ��������Ĵ�С��ͬ��п��Ӧ | ��Ӧ��ʼ��HA����H2�����ʸ��� | HA������ |
D | ��п����ϡ���ᷴӦ���Թ��еμӼ���CuSO4��Һ | ����������������Լӿ� | CuSO4�Ը÷�Ӧ�д����� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������(N2H4)��ˮ��Һ���У�
�� N2H4+H2O![]() N2H5++OH- K1
N2H5++OH- K1
�� N2H5++H2O![]() N2H62++OH- K2 ��
N2H62++OH- K2 ��
����Һ�е��������ʵ���������(X)��-lgc(OH-)�仯�Ĺ�ϵ��ͼ��ʾ�����������������

A. ͼ�Т��Ӧ����ΪN2H62+
B. ��Ӧ��ΪN2H5+��ˮ��ƽ�ⷽ��ʽ
C. ��C��ΪN2H5C1��Һ������ڣ�c(Cl-)>c(N2H5+ )+2c(N2H62+)
D. ��A�����K1=10-6
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com