
【题目】常温下,向20.00mL0.1000molL-1(NH4)2SO4溶液中逐滴加入0.2000molL-1NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发)。下列说法正确的是( )
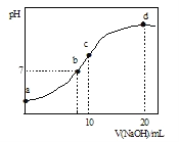
A.点a所示溶液中:c(NH4+)>c(SO42-)>c(OH-)>c(H+)
B.点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-)
C.点c所示溶液中:c(SO42-)+c(H+)=c(NH3H2O)+c(OH-)
D.点d所示溶液中:c(SO42-)>c(NH3H2O)>c(NH4+)>c(OH-)
【答案】C
【解析】
硫酸铵与NaOH发生NH4++OH-=NH3·H2O,按照盐类水解和弱电解质电离程度微弱,进行分析;
A. a点溶液时,溶液显酸性,c(H+)>c(OH-),故A说法错误;
B. b点溶液中,溶液呈中性,则![]() ,根据电荷守恒得
,根据电荷守恒得![]() ,硫酸铵的酸性较弱,要使混合溶液呈中性,则加入少量氢氧化钠即可,所以
,硫酸铵的酸性较弱,要使混合溶液呈中性,则加入少量氢氧化钠即可,所以![]() ,故B说法错误;
,故B说法错误;
C. c点溶液中,溶液呈碱性,所以![]() ,溶液中的溶质是等物质的量浓度的硫酸铵、硫酸钠、一水合氨,根据电荷守恒得
,溶液中的溶质是等物质的量浓度的硫酸铵、硫酸钠、一水合氨,根据电荷守恒得![]() ,根据物料守恒得,根据物料守恒得
,根据物料守恒得,根据物料守恒得![]() ,所以得
,所以得![]() ,故C说法正确;
,故C说法正确;
D. d点溶液中,二者恰好反应生成硫酸钠、NH3·H2O,且硫酸钠是氨水浓度的一半,一水合氨电离程度较小,所以![]() ,故D说法错误;
,故D说法错误;
答案:C。


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】根据下列表格中信息填写
有机物A | 有机物B | 有机物C | 有机物D |
1.该物质的产量是衡量一个国家石油化工水平的标志 2.比例模型: | 1.该物质为天然气的主要成分 2.比例模型: | 1.该物质由碳,氢,氧三种元素组成 2.75%的该物质的水溶液可做医用消毒剂 | 1.分子式为C2H4O2 2.该物质的水溶液显酸性,是家庭常用调味剂 |
(1)有机物A的结构简式为_________________,它与溴水反应的化学方程式为___________________。
(2)有机物B的空间构型为_______________________将有机物B与氧气分别通入如图装置的两极组成燃料电池,该电池的负极反应为____________________________正极反应为_____________________________。
(3)有机物D在水溶液中的电离方程式为_______________________。 将pH=3的D溶液加水稀释10倍,所得溶液的pH_____4(填“大于”,“小于”),0.1molD与等量的NaOH溶液恰好完全反应的生成物显__________性(填“酸”或“碱”),该溶液中存在的电荷守恒关系式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S水溶液中存在电离平衡:H2S![]() H++HS-和HS-
H++HS-和HS-![]() H++S2-,若向H2S溶液中( )
H++S2-,若向H2S溶液中( )
A.加入硫酸,平衡向右移动,溶液中氢离子浓度增大
B.通入过量SO2气体,溶液酸性减弱
C.通入氯气,平衡向左移动,溶液酸性增强
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项叙述中,正确的是
A.C6H5CH2CH2OH与C6H5OH互为同系物
B.CH3CHO与CH3COOH在一定条件下均能与新制氢氧化铜反应
C.![]() 与
与![]() 互为同分异构体
互为同分异构体
D.H2O与D2O互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,用0. 100 mol·L—1盐酸滴定50. 0mL Na2CO3溶液(不考虑CO2从溶液中逸出).滴定曲线如图所示:
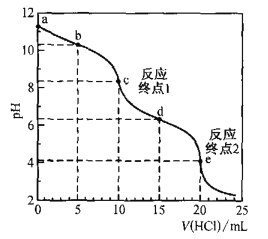
下列说法错误的是
A.a点溶液中:c(Na2CO3)=0.020 mol·L—1
B.b点溶液中:c(Na+)>c(HCO3— )>c(CO32—)
C.c点溶液中:c(Na+)+c(H+)=2c(CO32—) +c(HCO32—)+c(OH—)
D.室温时,H2CO3的一级电离平衡常数Kal的数量级为10—7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究草酸(H2C2O4)的性质,室温下进行以下两组实验:(已知:室温下,H2C2O4的电离平衡常数Ka1=5.0×10-2,Ka2=5.4×10-5)
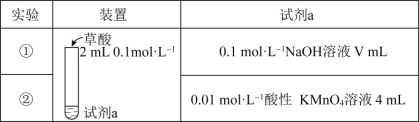
下列有关实验说法正确的是( )
A.若实验①中V=2,则混合后溶液中:c(C2O42-)>c(H2C2O4)
B.若实验①中V=4,则混合后溶液中:c(H+)+c(H2C2O4)+c(HC2O4-)=c(OH-)
C.实验②反应的离子方程式为5C2O42-+16H++2MnO4-=2Mn2++10CO2↑+8H2O
D.若实验②测得KMnO4溶液的褪色时间为40s,则这段时间内的平均反应速率v(KMnO4)=2.5×10-4molL-1s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.10molL-1盐酸滴定0.10molL-1氨水,滴定过程中NH3H2O、NH4+(假设:溶液中的含氮微粒只有NH3H2O和NH4+)的物质的量分数随pH的变化关系如图所示[例如:δ(NH3H2O)=![]() ]。下列判断正确的是( )
]。下列判断正确的是( )
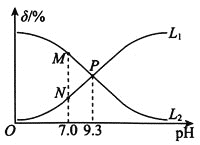
A.曲线L1代表δ(NH4+)与pH的变化关系
B.NH3H2O的电离常数Ka(NH3H2O)=1.0×10-4.7
C.水的电离程度:P>M
D.P点时混合溶液中存在:c(Cl-)=c(NH3H2O)+c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL未知浓度盐酸(酚酞作指示剂)的滴定曲线。下列说法正确的是( )

A.指示剂变色时,说明盐酸与NaOH恰好完全反应
B.当滴加NaOH溶液10.00 mL时,该混合液的pH=1+lg3
C.水电离出的氢离子浓度:a>b
D.盐酸的物质的量浓度为0.010 0 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个1.0 L的恒容密闭容器中分别进行反应2X(g)+Y(g)![]() Z(g) ΔH,达到平衡。相关数据如下表。
Z(g) ΔH,达到平衡。相关数据如下表。
容器 | 温度/K | 物质的起始浓度/ mol·L-1 | 物质的平衡浓度/ mol·L-1 | ||
c(X) | c(Y) | c(Z) | c(Z) | ||
I | 400 | 0.20 | 0.10 | 0 | 0.080 |
II | 400 | 0.40 | 0.20 | 0 | a |
III | 500 | 0.20 | 0.10 | 0 | 0.025 |
下列说法不正确的是
A. 平衡时,X的转化率:II>I
B. 平衡常数:K(II)>K(I)
C. 达到平衡所需时间:III<I
D. 反应的ΔH<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com