
【题目】M 是由两种阳离子、一种阴离子和结晶水组成的化合物。某学习小组的同学对该化合物进行了研究。
Ⅰ、取 M 的样品配成溶液,溶液呈棕黄色。将溶液分成三份,做了下列 3 组实验,分别检出 A、B、C 三种离子。请完成下表中的空格:
组别 | 操作 | 实验现象 | 检出的离子 |
第1组 | 加入足量的NaOH溶液并加热 | 产生的气体使湿润的红色石蕊试纸变蓝 | A:_____ |
第 2 组 | 加入KSCN溶液 | 溶液呈_____色 | B:Fe3+ |
第3组 | 加入_____和 BaCl2 溶液 | 有白色沉淀生成 | C: |
Ⅱ.取 9.640g M 配成溶液,加入足量的NaOH溶液,得到红褐色沉淀,将沉淀过滤、洗涤、灼烧,冷却后称量。经过4次灼烧,称量得到的红棕色固体的质量数据如表所示。
实验次数 | 第1次 | 第2次 | 第3次 | 第4次 |
质量 (g ) | 1.630 | 1.610 | 1.600 | 1.600 |
(1)灼烧和称量时需用图所示的仪器,它们的名称分别是:
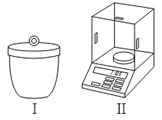
①_____②_____
(2)查阅资料并分析可知红棕色固体为Fe2O3,根据上表数据,可算得Fe2
(3)另取 9.640g M 配成溶液,加入足量的BaCl2溶液,得到白色沉淀,将沉淀过滤、洗涤、干燥,称得其质量为9.320g。小组同学提出 A、B、C 三种离子的物质的量存在以下关系:n (A )+3n (B )=2n (C),他们依据的原理是_____。
(4)分析整个实验过程,可以确定M的化学式为_____。
【答案】NH4+ 血红 稀盐酸 坩埚 电子天平 1.600 电荷守恒 NH4Fe (SO4 )212H2O
【解析】
Ⅰ、第1组加入足量的 NaOH 溶液并加热产生的气体使湿润的红色石蕊试纸变蓝,说明生成氨气;
第 2 组加入 KSCN 溶液,如溶液呈血红色,说明含有Fe3+;
第3组检验SO42﹣,应加入盐酸和氯化钡;
Ⅱ、由表中数据可知红棕色固体为Fe2O3,质量为1.600g,可计算n (Fe3+ ),另取 9.640g M 配成溶液,加入足量的BaCl2溶液,得到白色沉淀,将沉淀过滤、洗涤、干燥,称得其质量为9.320g,应为BaSO4,可计算n (SO42﹣),根据电荷守恒n (A )+3n (B )=2n (C )可计算n (NH4+ ),结合质量守恒计算结晶水,可计算M的化学式。
Ⅰ、第1组加入足量的 NaOH 溶液并加热产生的气体使湿润的红色石蕊试纸变蓝,说明生成氨气,则溶液中存在NH4+;
第 2 组加入KSCN溶液,如溶液呈血红色,说明含有Fe3+;
第3组检验SO42﹣,应加入盐酸和氯化钡,
故答案为:NH4+;血红;稀盐酸;
Ⅱ、 (1 )由仪器图可知Ⅰ为坩埚,Ⅱ为电子天平,故答案为:坩埚;电子天平;
(2 )加热到质量稳定时,可知氧化铁的质量为1.600g,故答案为:1.600;
(3 )溶液中存在的离子分别为NH4+、Fe3+、SO42﹣,存在n (NH4+ )+3n (Fe3+ )=2n (SO42﹣ ),为电荷守恒关系,故答案为:电荷守恒;
(4 )Fe2O3质量为1.600g,n (Fe3+ )=2×![]() =0.02mol,BaSO4质量为9.320g,n (SO42﹣)=
=0.02mol,BaSO4质量为9.320g,n (SO42﹣)=![]() =0.04mol,由n (NH4+ )+3n (Fe3+ )=2n (SO42﹣ ),可知n (NH4+ )=0.02mol,则由质量守恒可知n (H2O )=
=0.04mol,由n (NH4+ )+3n (Fe3+ )=2n (SO42﹣ ),可知n (NH4+ )=0.02mol,则由质量守恒可知n (H2O )=
![]() =0.24mol,
=0.24mol,
则n (NH4+ ):n (Fe3+ ):n (SO42﹣ ):n (H2O )=0.02:0.02:0.04:0.24=1:1:2:12,
所以M的化学式为NH4Fe (SO4 )212H2O,故答案为:NH4Fe (SO4 )212H2O。


科目:高中化学 来源: 题型:
【题目】化学与生产生活密切相关,下列有关说法中不正确的是
A. 酒精能使蛋白质变性,酒精纯度越高杀菌消毒效果越好
B. 酸雨以及光化学烟雾的形成通常都与氮的含氧化合物有关
C. 泡沫灭火器中用的是小苏打和硫酸铝
D. 金属焊接前常用NH4Cl溶液处理焊接处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚酰亚胺是重要的特种工程材料,广泛应用在航空、纳米、激光等领域。某聚酰亚胺的合成路线如下(部分反应条件略去):

已知:
①有机物A的质谱与核磁共振氢谱图如下:

②
③
回答下列问题:
(1)A的名称是__________________;C中含氧官能团的名称是________________。
(2)反应②的反应类型是____________________。
(3)反应①的化学方程式是__________________________。
(4) F的结构筒式是_____________________。
(5)同时满足下列条件的G的同分异构体共有___________种(不含立体结构);写出其中一种的结构简
式:________________。
①能发生银镜反应 ②能发生水解反应,其水解产物之一能与FeC13溶液发生显色反应
③1 mol该物质最多能与8 mol NaOH反应
(6) 参照上述合成路线,以间二甲苯和甲醇为原料(无机试剂任选)设计制备 的合成路线:_______________________。
的合成路线:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对相同物质的量的乙烯和丙烯,有下列叙述:①碳原子数之比为 2:3②氢原子数之比为 2:3③含碳的质量分数相同④分子个数之比为 1:1.其中正确的是 ( )
A.①④B.①②④C.①②③D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是

A. 通入保护电流使钢管桩表面腐蚀电流接近于零
B. 通电后外电路电子被强制从高硅铸铁流向钢管桩
C. 高硅铸铁的作用是作为损耗阳极材料和传递电流
D. 通入的保护电流应该根据环境条件变化进行调整
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是短周期中的四种常见元素,其相关信息如表:
元素 | 相关信息 |
X | X最外层电子数是次外层电子数的3倍 |
Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
Z | Z和Y同周期,Z的非金属性大于Y |
W | W的一种核素的质量数为23,中子数为12 |
(1)Y位于元素周期表第________周期________族,Y和Z的最高价氧化物对应的水化物的酸性较强的是________(填化学式)。
(2)Z的简单离子的电子式为________。
(3)W可以与X形成两种化合物,写出这两种化合物的电子式:__________________、____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐中常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:

提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-,选出a所代表的试剂,按滴加顺序依次为________(只填化学式)。
②分离操作①中所用到的玻璃仪器有____________。
③洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为________。
(2)用提纯的NaCl配制450 mL 4.00 mol·L-1NaCl溶液,所用仪器除药匙、烧杯、玻璃棒外还有________(填仪器名称)。
(3)在实验中多次用到玻璃棒,其作用有三个,分别是______________、______________、______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石的主要成分是K2SO4·Al2(SO4)3·2Al 2O3·6H2O,还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下:
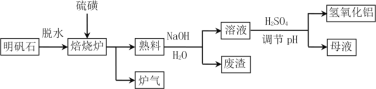
(1)焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S ![]() 2Al 2O3 +9SO2,该反应的氧化剂是______________,若生成1molAl2O3,则转移的电子数为____________________。
2Al 2O3 +9SO2,该反应的氧化剂是______________,若生成1molAl2O3,则转移的电子数为____________________。
(2)将标况下1.12L炉气通入100mL 0.5mol·L-1 NaOH溶液中,得到一种酸性溶液,则该溶液中各种离子浓度由大到小的排列顺序为___________________________________。
(3)熟料溶解时反应的离子方程式为_________________________。
(4)母液中溶质主要成分的化学式为____________、_____________,溶液调节pH后经过滤、洗涤可得Al(OH)3沉淀,证明沉淀已洗涤干净的实验操作和现象是 ________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
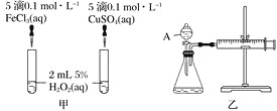
(1)若利用图甲装置,可通过观察__________现象,从而定性比较得出结论。
(2)有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是 ________。写出H2O2在二氧化锰催化作用下发生反应的化学方程式:___________。
(3)若利用乙实验可进行定量分析,图乙中仪器A的名称为________,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是________。
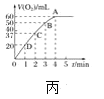
(4)将0.1molMnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示,解释反应速率变化的原因:________。H2O2初始物质的量浓度为_______(保留两位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com