
【题目】实验室可用少量的溴和足量的乙醇制备1,2—二溴乙烷,反应原理为:CH3CH2OH![]() CH2=CH2↑+H2O;CH2=CH2+Br2→BrCH2CH2Br。制备装置如图所示:
CH2=CH2↑+H2O;CH2=CH2+Br2→BrCH2CH2Br。制备装置如图所示:

下列说法中不正确的是( )
A. 使用恒压低液漏斗的目的是防止有机物挥发,使漏斗内液体顺利滴下
B. 实验中为了防止有机物大量挥发,应缓慢升高反应温度至170℃
C. 装置C中应加入氢氧化钠溶液,以吸收反应中可能生成的酸性气体
D. 实验过程中应用冷水冷却装置D,以避免溴的大量挥发
【答案】B
【解析】
A.因为有机物乙醇易挥发,使用恒压低液漏斗的目的是防止有机物挥发,使恒压低液漏斗上下压强相等,使漏斗内液体顺利滴下,故A正确;
B.实验中由CH3CH2OH和浓硫酸的混合液制CH2=CH2,为了减少副反应的发生,应迅速升温到170℃,故B错误;
C.由于浓硫酸具有强氧化性,CH3CH2OH具有还原性,浓硫酸会与CH3CH2OH发生氧化还原反应生成SO2、CO2和H2O,SO2也能与溴反应,装置C中加入氢氧化钠溶液,用于吸收反应中可能生成的酸性气体,故C正确;
D.由于溴易挥发,为了提高原料的利用率,实验过程中应用冷水冷却装置D,以避免溴的大量挥发,故D正确。
故选B。


 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
【题目】研究表明N2O与CO在Fe+作用下发生反应的能量变化及反应历程如图所示,下列说法错误的是
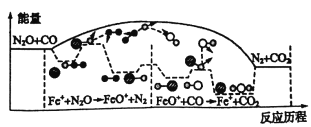
A. 反应总过程△H<0
B. Fe+使反应的活化能减小
C. 总反应若在2L的密闭容器中进行,温度越高反应速率一定越快
D. Fe++N2O→FeO++N2、FeO++CO→Fe++CO2两步反应均为放热及应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁单质及其化合物在生活、生产中应用广泛。请回答下列问题:
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应式为___________________。
(2)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是________________________________________________________________________。
(3)硫酸铁可作絮凝剂,常用于净水,其原理是______________________________(用离子方程式表示)。在使用时发现硫酸铁不能使酸性废水中的悬浮物沉降而除去,其原因是______________________________。
(4)磁铁矿是工业上冶炼铁的原料之一,其原理是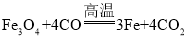 ,若有1.5mol Fe3O4参加反应,转移电子的物质的量是__________。
,若有1.5mol Fe3O4参加反应,转移电子的物质的量是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4X(X为卤素原子)的能量关系如下图所示。下列说法正确的是
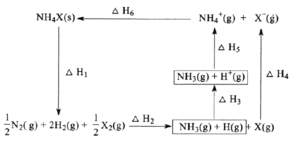
A. H1<H5
B. H6=H1+H2+H3+H4+H5
C. 已知NH4Cl溶于水吸热,则H6>0
D. 相同条件下,NH4Cl的(H2+H3+H5)比NH4Br的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有质量分数为98%、密度为1.84g·cm3的浓硫酸来配制500 mL、0.2mol·L1的稀硫酸。可提供选择的仪器有:①玻璃棒;②烧瓶;③烧杯;④胶头滴管;⑤量筒;⑥容量瓶;⑦托盘天平;⑧药匙。请回答下列问题:
(1)上述仪器这,在配制500mL、0.2mol·L1的稀硫酸时用不到的有___(填代号)
(2)经计算,需浓硫酸的体积为___mL。现有:a.10mL;b.50mL;c.100mL三种规格的量筒,你选用的量筒是___(填代号)。
(3)将浓硫酸加适量蒸馏水稀释后,冷却片刻,随后全部转移到___mL的容量瓶中,转移时应用玻璃棒___。转移完毕后,用少量蒸馏水洗涤___。2~3次,改用___加蒸馏水到瓶颈刻度___的地方,使溶液的___,振荡、摇匀后,装瓶、贴签。
(4)在配制过程中,其他操作都准确,下列操作中:错误的是___,能引起所配制溶液浓度偏低的有___(填代号)。
A.定容时,仰视刻度线
B.洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中
C.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
D.转移前,容量瓶中含有少量蒸馏水
E.定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
F.将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸
G.未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应或离子反应方程式正确的是( )
A.苯与溴水反应:![]() +Br2
+Br2![]() +HBr
+HBr
B.1一氯丙烷中加入氢氧化钠的水溶液并加热:CH3CH2CH2Cl+NaOH![]() CH3CH=CH2↑+NaCl+H2O
CH3CH=CH2↑+NaCl+H2O
C.苯酚钠溶液中通入少量CO2:2C6H5O-+H2O+CO2→2C6H5OH+CO32-
D.实验室制取乙炔的反应:CaC2+2H2O→Ca(OH)2+CH≡CH↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛在木材加工、医药等方面有重要用途。
I.利用甲醇(CH3OH)制备甲醛
脱氢法:CH3OH(g)HCHO(g)+H2(g) △H1=+92.09kJ·mol-1
氧化法:CH3OH(g)+1/2O2(g)HCHO(g)+H2O(g) △H2
(1)脱氢法制甲醛,有利于提高平衡产率的条件有____________。
A.低温 B.高温 C.低压 D.高压 E.催化剂
(2)已知:2H2(g)+O2(g)=2H2O(g) △H3=-483.64kJ·mol-1,则△H2=________。
(3)750K下,在恒容密闭容器中,充入一定量的甲醇,发生反应CH3OH(g)HCHO(g)+H2(g),若起始压强为101kPa,达到平衡转化率为50.0%,则反应的平衡常数Kp=__________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
(4)Na2CO3是甲醇脱氢制甲醛的催化剂,有研究指出,催化反应的部分机理如下:
历程i:CH3OH→·H+·CH2OH
历程ⅱ:·CH2OH→·H+HCHO
历程ⅲ:·CH2OH→3·H+CO
历程iv:·H+·H→H2
如图所示为在体积为1L的恒容容器中,投入1molCH3OH,在碳酸钠催化剂作用下,经过5min反应,测得甲醇的转化率(X)与甲醛的选择性(S)与温度的关系(甲醛的选择性:转化的CH3OH中生成HCHO的百分比),回答下列问题:
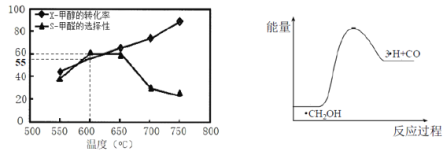
①600℃时,5min内甲醛的反应速率为____________。
②650℃-750℃甲醛选择性随温度下降,而甲醇转化率随温度升高的可能原因为________;
③700℃时,历程iii能量~反应过程如图所示,在答卷纸上绘制历程ii的“能量~反应过程”示意图。___________
II.室内甲醛超标会危害人体健康,通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理所示,则工作电极的电极反应式为_____________。
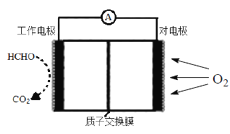
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的甲烷和氨气相比较,下列结论中错误的是( )
A.两种气体的分子个数之比为17∶16
B.同温同压下,两种气体的体积之比为17∶16
C.两种气体的氢原子个数之比为17∶12
D.同温同压下,两种气体的密度之比为17∶16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际计量大会第26届会议修订了阿伏加德罗常数(NA=6.02214076×1023mol-1),于2019年5月2日正式生效。设NA是阿伏加德罗常数的值,下列说法正确的是
A.40g正丁烷和18 g异丁烷的混合物中共价键数目为13NA
B.常温常压下,124 g P4中所含P—P键数目为4NA
C.电解精炼铜时,阳极质量减小3.2g时,转移的电子数为0.1NA
D.0.1mol FeCl3完全水解转化为氢氧化铁胶体,生成胶粒数目为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com