
【题目】现有质量分数为98%、密度为1.84g·cm3的浓硫酸来配制500 mL、0.2mol·L1的稀硫酸。可提供选择的仪器有:①玻璃棒;②烧瓶;③烧杯;④胶头滴管;⑤量筒;⑥容量瓶;⑦托盘天平;⑧药匙。请回答下列问题:
(1)上述仪器这,在配制500mL、0.2mol·L1的稀硫酸时用不到的有___(填代号)
(2)经计算,需浓硫酸的体积为___mL。现有:a.10mL;b.50mL;c.100mL三种规格的量筒,你选用的量筒是___(填代号)。
(3)将浓硫酸加适量蒸馏水稀释后,冷却片刻,随后全部转移到___mL的容量瓶中,转移时应用玻璃棒___。转移完毕后,用少量蒸馏水洗涤___。2~3次,改用___加蒸馏水到瓶颈刻度___的地方,使溶液的___,振荡、摇匀后,装瓶、贴签。
(4)在配制过程中,其他操作都准确,下列操作中:错误的是___,能引起所配制溶液浓度偏低的有___(填代号)。
A.定容时,仰视刻度线
B.洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中
C.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
D.转移前,容量瓶中含有少量蒸馏水
E.定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
F.将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸
G.未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中
【答案】②⑦⑧ 5.4 a 500 引流 烧杯和玻璃棒 胶头滴管 1~2cm 凹液面最低点与刻度线相切 ABCEFG ACE
【解析】
(1)将浓硫酸在烧杯中用少量水稀释,冷却至室温后用玻璃棒引流入500ml容量瓶中,向容量瓶中加水,至距刻度线1-2cm处,改用胶头滴管滴加水至凹液面最低点与刻度线相切,据此分析作答;
(2)先计算浓硫酸的浓度,在根据稀释定律进行计算;
(3)根据配制溶液的步骤填空;
(4)A.定容时,仰视刻度线,使读得的溶液体积偏大;
B.洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中,可使溶质的量增多;
C.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线,相当于稀释溶液;
D.转移前,容量瓶中含有少量蒸馏水,对实验结果没有影响;
E.定容时,加蒸馏水超过刻度线,又用胶头滴管吸出,会使溶质的量减少;
F.稀释浓硫酸应将浓硫酸缓缓沿烧杯壁注入水中;
G.液体有热胀冷缩的特点。
(1)根据分析可知,在配制500mL、0.2mol·L1的稀硫酸时需要玻璃棒、烧杯、胶头滴管、量筒、容量瓶,不需要的是烧瓶、托盘天平和药匙,即②⑦⑧;
(2)浓硫酸的浓度c(浓)=![]() =
=![]() =18.4mol/L,根据稀释定律可知V(浓)=
=18.4mol/L,根据稀释定律可知V(浓)=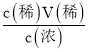 =
=![]() =0.0054L=5.4ml,量取是应选择10ml的量筒;
=0.0054L=5.4ml,量取是应选择10ml的量筒;
(3)将浓硫酸加适量蒸馏水稀释后,冷却片刻,随后全部转移到500mL的容量瓶中,转移时应用玻璃棒引流。转移完毕后,用少量蒸馏水洗涤烧杯和玻璃棒2~3次,改用胶头滴管加蒸馏水到瓶颈刻度1-2cm的地方,使溶液的凹液面最低点与刻度线相切,振荡、摇匀后,装瓶、贴签。
(4)A.定容时,仰视刻度线,操作错误,使读得的溶液体积偏大,导致溶液浓度偏低;
B.洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中,操作错误,可使溶质的量增多,导致溶液浓度偏高;
C.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线,操作错误,加入的水过多,使溶液的浓度偏低;
D.转移前,容量瓶中含有少量蒸馏水,对实验结果没有影响,溶液的浓度不变;
E.定容时,加蒸馏水超过刻度线,又用胶头滴管吸出,操作错误,会使溶质的量减少,导致溶液浓度偏低;
F.将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸,方法错误,但最终配制的溶液的浓度不变;
G.未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中,操作错误,溶液冷却后体积缩小,导致溶液的浓度偏高;
因此操作错误的是ABCEFG,能引起所配制溶液浓度偏低的有ACE。


 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】下列反应中,电子转移发生在同种物质的同种元素之间的是( )
A. 2H2S+SO2=3S+2H2OB. 2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
C. 2KClO3![]() 2KCl+3O2↑D. Cu2O+H2SO4=CuSO4+Cu+H2O
2KCl+3O2↑D. Cu2O+H2SO4=CuSO4+Cu+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铈元素(Ce)是镧系金属中自然丰度最高的一种,常见有+3、+4两种价态,铈的合金耐高温,可以用来制造喷气推进器零件。
请回答下列问题:
(1)雾霾中含有大量的污染物NO,可以被含Ce4+的溶液吸收,生成NO2-、NO3-(二者物质的量之比为1:1),该反应氧化剂与还原剂的物质的量之比为________。
(2)可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如图所示。

①Ce4+从电解槽的______(填字母序号)口流出。
②写出阴极的电极反应式________________。
(3)铈元素在自然界中主要以氟碳矿形式存在。主要化学成分为CeFCO3。工业上利用氟碳铈矿提取CeCl3的一种工艺流程如下:

①焙烧过程中发生的主要反应方程式为__________________。
②有同学认为酸浸过程中用稀硫酸和H2O2替换盐酸更好,他的理由是_________。
③Ce(BF4)3、KBF4的Ksp分别为a、b,则Ce(BF4)3(s)+3KCl(aq)![]() 3KBF4(s)+CeCl3(aq)平衡常数为________(用a、b的代数式表示)。
3KBF4(s)+CeCl3(aq)平衡常数为________(用a、b的代数式表示)。
④加热CeCl3·6H2O和NH4Cl的固体混合物可得固体无水CeCl3,其中NH4Cl的作用是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:① CH3CH=CHCH2CH3![]() CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH
② R-CH=CH2![]() R-CH2-CH2-Br
R-CH2-CH2-Br
香豆素的核心结构是芳香内酯A,A经下列步骤转变为水杨酸。
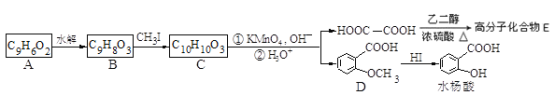
请回答下列问题:
(1)下列有关A、B、C的叙述中不正确的是___________
a. C中核磁共振氢谱共有8种峰
b. A、B、C均可发生加聚反应
c. 1mol A最多能和5mol氢气发生加成反应
d. B能与浓溴水发生取代反应
(2)B分子中有2个含氧官能团,分别为______和______(填官能团名称),B→C的反应类型为_____________。
(3)在上述转化过程中,反应步骤B→C的目的是_________________________。
(4)化合物D有多种同分异构体,其中一类同分异构体是苯的对二取代物,且水解后生成的产物之一能发生银镜反应。请写出其中一种的结构简式:_____________。
(5)写出合成高分子化合物E的化学反应方程式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《Journal of Energy Chemistry》报导我国科学家设计CO2熔盐捕获与转化装置如图。下列有关说法正确的是
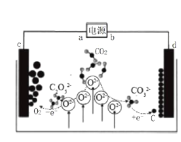
A. b为电源的正极
B. 电子流向:c→a→b→d
C. c极电极反应式为2C2O52――4e-=4CO2+O2
D. 转移0.4mol电子可捕获CO2 2.24L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用少量的溴和足量的乙醇制备1,2—二溴乙烷,反应原理为:CH3CH2OH![]() CH2=CH2↑+H2O;CH2=CH2+Br2→BrCH2CH2Br。制备装置如图所示:
CH2=CH2↑+H2O;CH2=CH2+Br2→BrCH2CH2Br。制备装置如图所示:

下列说法中不正确的是( )
A. 使用恒压低液漏斗的目的是防止有机物挥发,使漏斗内液体顺利滴下
B. 实验中为了防止有机物大量挥发,应缓慢升高反应温度至170℃
C. 装置C中应加入氢氧化钠溶液,以吸收反应中可能生成的酸性气体
D. 实验过程中应用冷水冷却装置D,以避免溴的大量挥发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用图示装置进行实验,反应进行足够长时间后装置II中实验现象正确的是
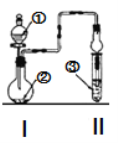
① | ② | ③ | II中实验现象 | |
A | 浓盐酸 | 大理石 | 氯化钡溶液 | 产生大量白色沉淀 |
B | 浓氨水 | 碱石灰 | 硫酸亚铁溶液 | 产生大量白色沉淀 |
C | 冰醋酸 | 乙醇和浓硫酸 | 饱和碳酸钠溶液 | 溶液分层,上层为油状液体 |
D | 浓盐酸 | KMnO4 | 氢硫酸 | 产生淡黄色沉淀 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间有如下转化关系: 下列有关物质的推断不正确的是 ( )
下列有关物质的推断不正确的是 ( )
A. 若甲为AlC13溶液,则丁可能是NaOH溶液 B. 若甲为N2,则丁可能是O2
C. 若甲为Fe,则丁可能是稀硝酸 D. 若甲为NaOH溶液,则丁可能是CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里迅速制备少量氯气可利用以下反应:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,此反应不需要加热,常温下就可以迅速进行,而且对盐酸的浓度要求不高。
(1)用双线桥法表示出电子转移的方向和数目__________。2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
(2)该反应中,氧化剂是__________,还原剂是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com