
【题目】Na2CO3溶液中存在水解平衡:CO32-+H2O ![]() HCO3-+OH-。下列说法错误的是
HCO3-+OH-。下列说法错误的是
A.加水稀释,溶液中所有离子的浓度都减小
B.通入CO2,溶液pH增大
C.加入NaOH固体,c(HCO3-)/c(CO32-)减小
D.升高温度,平衡常数增大
科目:高中化学 来源: 题型:
【题目】(1)葡萄酒中SO2最大使用量为0.25g·L-1,取300.00mL葡萄酒,通过适当的方法使所含SO2全部逸出并用H2O2将其全部氧化为H2SO4,然后用0.0900mol·L-1NaOH标准溶液进行滴定。
①滴定前排气泡时,应选择如图中的___(填序号)

②若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积___(填序号)。
①=10mL ②=40mL ③<10 mL ④>40 mL。
③上述滴定实验中若滴定终点时溶液的pH=8.8,则选择的指示剂为______,选择该指示剂时如何判断反应到达滴定终点:______。
④滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为___g·L-1;滴定终点读数时俯视刻度线,则测量结果比实际值______(填“偏高”、“偏低”或“无影响”)。
(2)某学生用0.100molL-1的KOH标准溶液滴定未知浓度的盐酸,其操作为:
A.移取20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3cm 处;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管下面,用标准KOH溶液滴定至终点并记下刻度。
实验编号 | KOH溶液的浓度(mol/L) | 滴定完成时,KOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
①正确操作步骤的顺序是(用序号字母填写)_________。
②根据上述数据,可计算出该盐酸的浓度约为_______(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸及其钠盐可用作乳胶、牙膏、果酱或其他食品的抑菌剂,也可广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸。主要实验装置(回流搅拌装置)如图所示:
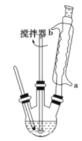
反应原理:
![]() +2KMnO4→
+2KMnO4→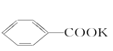 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
![]() +HCl→
+HCl→![]() +KCl
+KCl
实验方法:将一定量的甲苯和KMnO4溶液置于三颈烧瓶中,在90℃时反应一段时间后,停止反应,按如图流程分离出苯甲酸并回收未反应的甲苯。
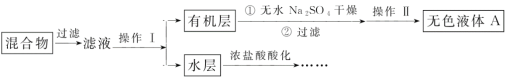
(1)无色液体A的结构简式为___,操作Ⅱ为___;
(2)如果滤液呈紫色,要先加饱和亚硫酸钾溶液,过滤后再进行操作Ⅰ。加饱和亚硫酸钾溶液的目的是___,写出该反应的离子方程式:___;
(3)冷却水应该从冷凝管___(填“a”或“b”)口流入;
(4)要由“水层”得到苯甲酸晶体,应进行下列操作,正确的操作顺序是___(填选项字母):
A.酸化 B.过滤 C.蒸发浓缩 D.冷却结晶
(5)纯度测定:称取1.22g产品,配成100mL溶液,取其中25.00mL溶液,用KOH溶液进行滴定,消耗KOH的物质的量为2.40×10-3mol,则产品中苯甲酸的质量分数为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究Na2O2与H2O的反应,进行了如下实验:
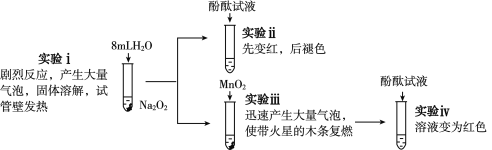
有关说法不正确的是( )
A.实验ⅰ中发生反应的化学方程式为2Na2O2+2H2O===4NaOH+O2↑
B.实验ⅲ中MnO2做H2O2分解反应的催化剂
C.综合实验ⅰ和ⅲ可以说明Na2O2与H2O反应有H2O2生成
D.综合实验ⅱ和ⅲ可以说明使酚酞褪色的是O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋(83号元素)主要用于制造合金,铋合金具有凝固时不收缩的特性,用于铸造印刷铅字和高精度铸型。湿法提铋新工艺以氧化铋渣(主要成分为![]() ,含有
,含有![]() 、
、![]() 、
、![]() 杂质)为原料提Bi的工艺流程如下:
杂质)为原料提Bi的工艺流程如下:
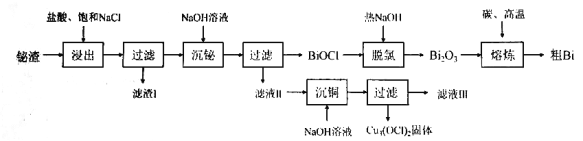
已知:Ⅰ.![]() 不溶于水,加热至700℃就分解生成
不溶于水,加热至700℃就分解生成![]() ,
,![]() 的沸点为447℃。
的沸点为447℃。
Ⅱ.25℃时,![]() ;
;![]() 。
。
回答下列问题:
(1)铋在元素周期表中的位置为___________________。
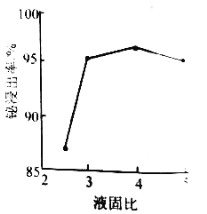
(2)“浸出”时,在盐酸浓度![]() 、浸出温度70℃、浸出时间2h及不同浸出液固比条件下进行浸出实验,浸出率与液固比的关系如图所示,最合适的液固比应选__________。
、浸出温度70℃、浸出时间2h及不同浸出液固比条件下进行浸出实验,浸出率与液固比的关系如图所示,最合适的液固比应选__________。
(3)“滤渣Ⅰ”的成分为_____________(填化学式)。
(4)“脱氯”的化学方程式为___________________。
(5)“沉铜”时,向“滤液Ⅱ”中加入NaOH溶液调节pH,促进![]() 水解生成
水解生成![]() ,则此过程中
,则此过程中![]() 水解的离子方程式为_________________________。若“滤液Ⅱ”中
水解的离子方程式为_________________________。若“滤液Ⅱ”中![]() 为
为![]() ,当加入等体积的NaOH溶液时,pH恰好为6,出现沉淀
,当加入等体积的NaOH溶液时,pH恰好为6,出现沉淀![]() ,此时
,此时![]() 的去除率为________(忽略溶液体积变化)。
的去除率为________(忽略溶液体积变化)。
(6)“滤液Ⅲ”经加热浓缩后可返回____________工序循环使用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究碳酸钙与盐酸反应的反应速率,某同学通过实验测定反应中生成的CO2气体体积,并绘制出如图所示的曲线。请回答以下问题。
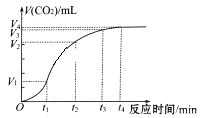
(1)化学反应速率最快的时间段是_________,原因是________________。
A.0~t1 B.t1-t2 C. t2~t3 D.t3~t4
(2)为了减缓上述反应速率,欲向盐酸溶液中加入下列物质,你认为可行的有_________。
A.蒸馏水 B.NaCl固体
C.NaCl溶液 D.通入HCl
(3)若盐酸溶液的体积是20mL,图中CO2的体积是标准状况下的体积,则t1~t2时间段平均反应速率v(HCl)=________________mol·L-1·min-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃时,现有pH=2的HCl溶液100mL,要使它的pH=3,如果加入蒸馏水,需加水______________mL;如果加入pH=4的HCl溶液,需加入此HCl溶液_____________mL。(假定溶液体积有加和性,下同)
(2)25℃时,将pH=8的NaOH溶液与pH=13的NaOH溶液等体积混合后,溶液的pH=________________。(lg2=0.3)
(3)25℃时,将0.1mol·L-1盐酸和0.06mol·L-1氢氧化钡溶液等体积混合后,该混合溶液的pH=___________。
(4)25℃时,pH=a的X体积的某强酸与pH=b的Y体积的某强碱混合后,溶液呈中性,已知a+b=15,则X:Y=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容密闭容器中发生反应2A(g)+B(g)![]() 2C(g),若反应物A的浓度由0.1 mol·L-1降到0.06 mol·L-1需20 s,那么由0.06 mol·L-1降到0.036 mol·L-1所需的时间为( )
2C(g),若反应物A的浓度由0.1 mol·L-1降到0.06 mol·L-1需20 s,那么由0.06 mol·L-1降到0.036 mol·L-1所需的时间为( )
A. 等于10 s B. 等于12 s
C. 大于12 s D. 小于12 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积为5L的密闭容器中,0.5molX和0.5molY进行反应:
2X(g)+Y(g)![]() 2Z(g),经60s达到平衡,生成0.2molZ。下列说法正确的是:
2Z(g),经60s达到平衡,生成0.2molZ。下列说法正确的是:
A. 将容器体积变为10L,Z的平衡浓度变为原来的![]()
B. 在该温度下,该反应的平衡常数K=0.011
C. 达到平衡时,容器内气体的压强是原来的90%
D. 若降低温度,X的体积分数增大,则该反应的△H<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com