
ЁОЬтФПЁПЕчЖЦЗЯЫЎжаГЃКЌгавѕРызгAЃЌХХЗХЧАПЩМгCuSO4ШмвКДІРэЃЌЪЙжЎзЊЛЏЮЊГСЕэBЃЌАДШчЯТСїГЬНјааЪЕбщЁЃ
вбжЊЃКBКЌШ§жждЊЫиЃЛЦјЬхDБъПіЯТУмЖШ2.32g/LЃЛЛьКЯЦјЬхlЮоЩЋЮоЮЖЃЛЦјЬхFБъПіЯТУмЖШЮЊ1.25g/LЁЃЧыЛиД№ЃК
ЃЈ1ЃЉзщГЩBЕФШ§жждЊЫиЪЧ___ЃЌЦјЬхDЕФЗжзгЪНЪЧ___ЁЃ
ЃЈ2ЃЉаДГіЙЬЬхCдкзуСПбѕЦјжазЦЩеЕФЗНГЬЪН___ЁЃ
ЃЈ3ЃЉЙЬЬхCдкЗаЬкЕФЯЁбЮЫсжаЛсЩњГЩвЛжжШѕЫсКЭвЛжжАзЩЋГСЕэЃЌИУАзЩЋГСЕэЪЧЙВМлЛЏКЯЮяЃЈВтЦфЗжзгСПЮЊ199)ЃЌдђЗДгІЕФЛЏбЇЗНГЬЪНЪЧ___ЁЃ
ЁОД№АИЁПCuЁЂCЁЂN (CN)2 2CuCNЃЋ3O2![]() 2CuOЃЋ2CO2ЃЋN2 2CuCN+2HCl
2CuOЃЋ2CO2ЃЋN2 2CuCN+2HCl![]() Cu2Cl2+2HCN
Cu2Cl2+2HCN
ЁОНтЮіЁП
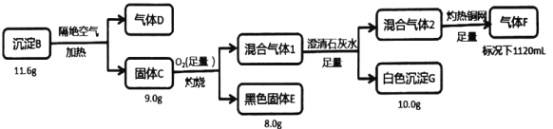
ЕчЖЦЗЯЫЎжаГЃКЌгавѕРызгAЃЌХХЗХЧАПЩМгCuSO4ШмвКДІРэЃЌЪЙжЎзЊЛЏЮЊГСЕэBЃЌГСЕэBУїЯдКЌгаЭдЊЫиЃЌИєОјПеЦјМгШШКѓЕФЙЬЬхCгІКЌЭдЊЫиЃЌзЦЩеКѓКкЩЋЙЬЬхEгІЮЊCuO 8.0gЃЌCuOЕФЮяжЪЕФСП=![]() =0.1molЃЌИљОнCuЪиКуЃЌBЁЂCжаCuдЊЫиЕФЮяжЪЕФСП0.1molЃЌCuдЊЫижЪСПЮЊ0.1molЁС64g/mol=6.4gЃЌCдкзуСПO2зЦЩеКѓВњЩњЕФЛьКЯЦјЬх1ЭЈШызуСПГЮЧхЪЏЛвЫЎЃЌВњЩњ10gАзЩЋГСЕэGЃЌдђGЮЊCaCO3ЃЌЛьКЯЦјЬх1жаКЌгаCO2КЭЮДЗДгІЕФO2ЃЌИљОнCЪиКуЃЌЙЬЬхCжаКЌгаКЌгаCдЊЫиЃЌЦфЮяжЪЕФСПЮЊ
=0.1molЃЌИљОнCuЪиКуЃЌBЁЂCжаCuдЊЫиЕФЮяжЪЕФСП0.1molЃЌCuдЊЫижЪСПЮЊ0.1molЁС64g/mol=6.4gЃЌCдкзуСПO2зЦЩеКѓВњЩњЕФЛьКЯЦјЬх1ЭЈШызуСПГЮЧхЪЏЛвЫЎЃЌВњЩњ10gАзЩЋГСЕэGЃЌдђGЮЊCaCO3ЃЌЛьКЯЦјЬх1жаКЌгаCO2КЭЮДЗДгІЕФO2ЃЌИљОнCЪиКуЃЌЙЬЬхCжаКЌгаКЌгаCдЊЫиЃЌЦфЮяжЪЕФСПЮЊ![]() =0.1molЃЌжЪСПЮЊ0.1molЁС12g/mol=1.2gЃЌЗДгІКѓЕФЛьКЯЦјЬх2ЃЌЭЈЙ§зЦШШЕФЭЭјЭъШЋЗДгІКѓЃЌЪЃгр1120mLЦјЬхFЃЌНсКЯЦјЬхFБъПіЯТУмЖШЮЊ1.25g/LЃЌЦјЬхFФІЖћжЪСПЮЊ1.25g/LЁС22.4L/mol =28g/molЃЌЭЦВтЮЊN2ЃЌЕЊЦјЕФЮяжЪЕФСП=
=0.1molЃЌжЪСПЮЊ0.1molЁС12g/mol=1.2gЃЌЗДгІКѓЕФЛьКЯЦјЬх2ЃЌЭЈЙ§зЦШШЕФЭЭјЭъШЋЗДгІКѓЃЌЪЃгр1120mLЦјЬхFЃЌНсКЯЦјЬхFБъПіЯТУмЖШЮЊ1.25g/LЃЌЦјЬхFФІЖћжЪСПЮЊ1.25g/LЁС22.4L/mol =28g/molЃЌЭЦВтЮЊN2ЃЌЕЊЦјЕФЮяжЪЕФСП=![]() =0.05molЃЌжЪСПЮЊ0.05molЁС28g/mol=1.4gЃЌИљОнзЊЛЏСїГЬЗжЮіЃЌШєFЮЊN2ЃЌдђCuЁЂCЁЂNдЊЫиЖМРДздгкЙЬЬхCЃЌМДCгЩCuЁЂCЁЂNШ§жждЊЫизщГЩЃЌдйИљОнm(Cu)+ m(C)+ m(N)=6.4g+1.2g+1.4g=9gЃЌИеКУЕШгкВЮгыЗДгІЕФЙЬЬхCЕФжЪСПЃЌгЩДЫПЩШЗЖЈЃЌFЮЊN2ЃЌCгЩCuЁЂCЁЂNШ§жждЊЫизщГЩЃЌЧвn(Cu)ЃКn(C)ЃКn(N)=0.1molЃК0.1molЃК0.05molЁС2=1ЃК1ЃК1ЃЌдђЙЬЬхCЕФЛЏбЇЪНЮЊCuCNЃЌЛьКЯЦјЬх1ЮЊCO2ЁЂO2ЁЂN2ЕФЛьКЯЦјЬхЃЌЛьКЯЦјЬх2ЮЊO2ЁЂN2ЕФЛьКЯЦјЬхЃЛгЩгкГСЕэBвВЪЧгЩШ§жждЊЫизщГЩЃЌИєОјПеЦјМгШШЗжНтЮЊCКЭDЃЌУЛгаЭтРДдЊЫиЃЌдђBвВЪЧгЩCuЁЂCЁЂNШ§жждЊЫизщГЩЃЌBЮЊ11.6gЃЌCЮЊ9gЃЌИљОнжЪСПЪиКуЃЌDЕФжЪСПЮЊ2.6gЃЌЦјЬхDБъПіЯТУмЖШ2.32g/LЃЌдђDФІЖћжЪСПЮЊ2.32g/LЁС22.4L/molЁж52g/molЃЌдђ ЦјЬхDЕФЮяжЪЕФСПЮЊ
=0.05molЃЌжЪСПЮЊ0.05molЁС28g/mol=1.4gЃЌИљОнзЊЛЏСїГЬЗжЮіЃЌШєFЮЊN2ЃЌдђCuЁЂCЁЂNдЊЫиЖМРДздгкЙЬЬхCЃЌМДCгЩCuЁЂCЁЂNШ§жждЊЫизщГЩЃЌдйИљОнm(Cu)+ m(C)+ m(N)=6.4g+1.2g+1.4g=9gЃЌИеКУЕШгкВЮгыЗДгІЕФЙЬЬхCЕФжЪСПЃЌгЩДЫПЩШЗЖЈЃЌFЮЊN2ЃЌCгЩCuЁЂCЁЂNШ§жждЊЫизщГЩЃЌЧвn(Cu)ЃКn(C)ЃКn(N)=0.1molЃК0.1molЃК0.05molЁС2=1ЃК1ЃК1ЃЌдђЙЬЬхCЕФЛЏбЇЪНЮЊCuCNЃЌЛьКЯЦјЬх1ЮЊCO2ЁЂO2ЁЂN2ЕФЛьКЯЦјЬхЃЌЛьКЯЦјЬх2ЮЊO2ЁЂN2ЕФЛьКЯЦјЬхЃЛгЩгкГСЕэBвВЪЧгЩШ§жждЊЫизщГЩЃЌИєОјПеЦјМгШШЗжНтЮЊCКЭDЃЌУЛгаЭтРДдЊЫиЃЌдђBвВЪЧгЩCuЁЂCЁЂNШ§жждЊЫизщГЩЃЌBЮЊ11.6gЃЌCЮЊ9gЃЌИљОнжЪСПЪиКуЃЌDЕФжЪСПЮЊ2.6gЃЌЦјЬхDБъПіЯТУмЖШ2.32g/LЃЌдђDФІЖћжЪСПЮЊ2.32g/LЁС22.4L/molЁж52g/molЃЌдђ ЦјЬхDЕФЮяжЪЕФСПЮЊ![]() 0.05molЃЌCжаГ§CuЭтЕФCN-ЕФжЪСПЮЊ9g-6.4g=2.6gЃЌCN-ЕФЮяжЪЕФСПЮЊ
0.05molЃЌCжаГ§CuЭтЕФCN-ЕФжЪСПЮЊ9g-6.4g=2.6gЃЌCN-ЕФЮяжЪЕФСПЮЊ![]() =0.1molЃЌBжаГ§CuЭтЕФжЪСПЮЊ11.6-6.4=5.2gЃЌдђBЕФЛЏбЇЪНЮЊCu(CN)2ЃЛЧАУцЕФЗжЮіжаШЗЖЈЃЌBжаКЌгаCu0.1molЃЌдђBжаКЌгаCN-ЕФЮяжЪЕФСПЮЊ0.2molЃЌИљОндзгЪиКуЃЌDжаКЌгаCNЮЊ0.1molЃЌдђDЕФЗжзгЪНЮЊ(CN)2ЃЌОнДЫЗжЮіНтД№ЁЃ
=0.1molЃЌBжаГ§CuЭтЕФжЪСПЮЊ11.6-6.4=5.2gЃЌдђBЕФЛЏбЇЪНЮЊCu(CN)2ЃЛЧАУцЕФЗжЮіжаШЗЖЈЃЌBжаКЌгаCu0.1molЃЌдђBжаКЌгаCN-ЕФЮяжЪЕФСПЮЊ0.2molЃЌИљОндзгЪиКуЃЌDжаКЌгаCNЮЊ0.1molЃЌдђDЕФЗжзгЪНЮЊ(CN)2ЃЌОнДЫЗжЮіНтД№ЁЃ
(1)ИљОнЗжЮіЃЌзщГЩBЕФШ§жждЊЫиЪЧCuЁЂCЁЂNШ§дЊЫиЃЌЦјЬхDЕФЗжзгЪНЪЧ(CN)2ЃЛ
(2)ЙЬЬхCЮЊCuCNЃЌдкзуСПбѕЦјжазЦЩеЩњГЩCuOЁЂCO2КЭN2ЃЌдђЗНГЬЪН2CuCNЃЋ3O2![]() 2CuOЃЋ2CO2ЃЋN2ЃЛ
2CuOЃЋ2CO2ЃЋN2ЃЛ
(3)CuCNгыбЮЫсЗДгІЩњГЩШѕЫсЮЊHCNЃЌГСЕэИљОнФІЖћжЪСППЩЭЦЖЯЦфЮЊCu2Cl2ЃЌЙЪ2CuCN+2HCl![]() Cu2Cl2+2HCNЁЃ
Cu2Cl2+2HCNЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЛњЗДгІЗНГЬЪНЪщаДМАЦфЗДгІРраЭЖМе§ШЗЕФЪЧЃЈ ЃЉ
A. ![]()
![]()
 ШЁДњЗДгІ
ШЁДњЗДгІ
B. 2CH3CHO+O2![]() 2CH3COOH бѕЛЏЗДгІ
2CH3COOH бѕЛЏЗДгІ
C. CH2=CH2+Br2 Ёњ CH3CHBr2 МгГЩЗДгІ
D. HCOOH+CH3CH2OH ![]() HCOOCH3CH2+H2O ѕЅЛЏЗДгІ
HCOOCH3CH2+H2O ѕЅЛЏЗДгІ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТЭМЪЧжЦБИКЭбаОПввШВаджЪЕФЪЕбщзАжУЭМЃЌгаЙиЫЕЗЈВЛе§ШЗЕФЪЧ

A. гУеєСѓЫЎЬцДњaжаБЅКЭЪГбЮЫЎВњЩњЕФввШВИќЮЊДПОЛ
B. c(Й§СП)ЕФзїгУЪЧГ§ШЅгАЯьКѓајЪЕбщЕФдгжЪ
C. dЁЂeжаШмвКЭЪЩЋЕФдРэВЛЭЌ
D. fДІВњЩњУїССЁЂАщгаХЈбЬЕФЛ№бц
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙигкЛЏбЇЗДгІЃЌЯТСаа№ЪіжаВЛе§ШЗЕФЪЧ ( )
ЂйЗХШШЕФЗДгІЗЂЩњЪБВЛБиМгШШ ЂкЛЏбЇЗДгІвЛЖЈгаФмСПБфЛЏ ЂлЮќШШЗДгІашвЊМгШШКѓВХФмЗЂЩњ ЂмЛЏбЇЗДгІШШаЇгІЪ§жЕгыВЮМгЗДгІЕФЮяжЪЕФСПЖрЩйгаЙиЁЃ
A. ЂкЂмB. ЂкЂлC. ЂйЂлD. ЂйЂк
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЮТЖШЮЊT1ЪБЃЌдкШ§ИіШнЛ§ОљЮЊ1LЕФКуШнУмБеШнЦїжаНіЗЂЩњЗДгІЃК2NO2(g)![]() 2NO(g)+O2(g)(е§ЗДгІЮќШШ)ЁЃЪЕбщВтЕУЃКvе§=v(NO2)ЯћКФ=kе§c2(NO2)ЃЌvФц=v(NO)ЯћКФ=2v(O2)ЯћКФ=kФцc2(NO)ЁЄc(O2)ЃЌkе§ЁЂkФцЮЊЫйТЪГЃЪ§ЃЌЪмЮТЖШгАЯьЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
2NO(g)+O2(g)(е§ЗДгІЮќШШ)ЁЃЪЕбщВтЕУЃКvе§=v(NO2)ЯћКФ=kе§c2(NO2)ЃЌvФц=v(NO)ЯћКФ=2v(O2)ЯћКФ=kФцc2(NO)ЁЄc(O2)ЃЌkе§ЁЂkФцЮЊЫйТЪГЃЪ§ЃЌЪмЮТЖШгАЯьЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
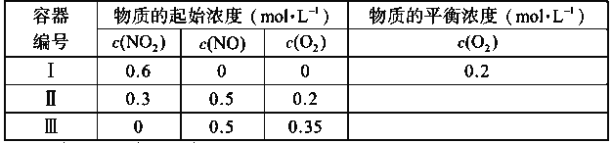
A.ДяЦНКтЪБЃЌШнЦїЂёгыШнЦїЂђжаЕФзмбЙЧПжЎБШЮЊ4ЁУ5
B.ДяЦНКтЪБЃЌШнЦїЂђжа![]() БШШнЦїЂёжаЕФДѓ
БШШнЦїЂёжаЕФДѓ
C.ДяЦНКтЪБЃЌШнЦїЂѓжаNOЕФЬхЛ§ЗжЪ§аЁгк50%
D.ЕБЮТЖШИФБфЮЊT2ЪБЃЌШєkе§=kФцЃЌдђT2>T1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПяЎКЃЫЎЕчГиЕФЗДгІдРэЮЊЃК2LiЃЋ2H2OЃН2LiOHЃЋH2ЁќЃЌЦфЪОвтЭМШчЭМЫљЪОЁЃгаЙиИУЕчГиЙЄзїЪБЫЕЗЈДэЮѓЕФЪЧ

A.Н№ЪєяЎзїе§МЋ
B.ФјЕчМЋЩЯЗЂЩњЛЙдЗДгІ
C.КЃЫЎзїЮЊЕчНтжЪШмвК
D.ПЩНЋЛЏбЇФмзЊЛЏЮЊЕчФм
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЗД-2-МКЯЉШЉ(D)ЪЧвЛжжживЊЕФКЯГЩЯуСЯЃЌЯТСаКЯГЩТЗЯпЪЧжЦБИDЕФЗНЗЈжЎвЛЁЃИљОнИУКЯГЩТЗЯпЛиД№ЯТСаЮЪЬтЃК
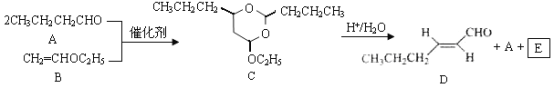
вбжЊЃК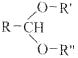
![]() RCHO+RЃЇOH+RЃЂOH
RCHO+RЃЇOH+RЃЂOH
ЃЈ1ЃЉAЕФУћГЦЪЧ__________ЃЛBЗжзгжаЙВУцдзгЪ§ФПзюЖрЮЊ__________ЃЛCЗжзгжагыЛЗЯрСЌЕФШ§ИіЛљЭХжаЃЌВЛЭЌЛЏбЇЛЗОГЕФЧтдзгЙВга__________жжЁЃ
ЃЈ2ЃЉDжаКЌбѕЙйФмЭХЕФУћГЦЪЧ__________ЃЌаДГіМьбщИУЙйФмЭХЕФЛЏбЇЗДгІЗНГЬЪНЃК__________ЁЃ
ЃЈ3ЃЉEЮЊгаЛњЮяЃЌФмЗЂЩњЕФЗДгІга__________ЁЃ
aЃЎОлКЯЗДгІbЃЎМгГЩЗДгІcЃЎЯћШЅЗДгІdЃЎШЁДњЗДгІ
ЃЈ4ЃЉBЕФЭЌЗжвьЙЙЬхFгыBгаЭъШЋЯрЭЌЕФЙйФмЭХЃЌаДГіFЫљгаПЩФмЕФНсЙЙЃК________ЁЃ
ЃЈ5ЃЉвдDЮЊжївЊдСЯжЦБИМКШЉ(ФПБъЛЏКЯЮя)ЃЌдкЗНПђжаНЋКЯГЩТЗЯпЕФКѓАыВПЗжВЙГфЭъећЁЃ
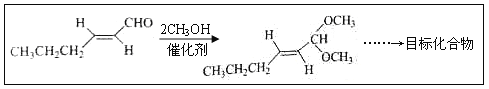
ЃЈ6ЃЉЮЪЬтЃЈ5ЃЉЕФКЯГЩТЗЯпжаЕквЛВНЗДгІЕФФПЕФЪЧ__________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈЁЁЁЁЃЉ
A. ввДМШМЩеЪЧЩњГЩЮязмФмСПИпгкЗДгІЮязмФмСПЕФЗДгІ
B. ЯЁШмвКжаЃЌH+ЃЈaqЃЉ+OHЉЃЈaqЃЉ=H2OЃЈlЃЉЁїH=Љ57.3 kJ/molПЩБэЪОЯЁСђЫсгыЯЁBaЃЈOHЃЉ2ШмвКЗДгІЕФжаКЭШШЮЊЁїH=Љ57.3 kJ/mol
C. 2H2SЃЈgЃЉ+3O2ЃЈgЃЉ=2SO2ЃЈgЃЉ+2H2OЃЈlЃЉЁїH=ЉQkJ/molПЩвдБэЪОH2SЕФШМЩеШШ
D. ИпЮТЯТЃЌФГЗДгІДяЕНЦНКтЃЌЦНКтГЃЪ§ЮЊK=![]() ЃЌКуШнЪБЃЌЮТЖШЩ§ИпЃЌH2ХЈЖШМѕаЁЃЌЙЪИУЗДгІЕФьЪБфЮЊе§жЕ
ЃЌКуШнЪБЃЌЮТЖШЩ§ИпЃЌH2ХЈЖШМѕаЁЃЌЙЪИУЗДгІЕФьЪБфЮЊе§жЕ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com