


科目:高中化学 来源: 题型:
| A、生铁、普通钢和不锈钢中的碳含量依次增加 |
| B、硅酸钠的水溶液俗称水玻璃,可用作木材防腐剂 |
| C、节日燃放的烟花是某些金属元素发生焰色反应所呈现出来的色彩 |
| D、明矾在自然水中生成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
| A | 盐酸 | 泥水 | 食盐 | 氨水 |
| B | 苛性钾 | 碘酒 | 醋酸 | 干冰 |
| C | 石油 | 石灰石 | 磷酸 | 水 |
| D | 苏打 | 天然气 | 二氧化硫 | 酒精 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 微粒代码 | a | b | c | d | e | f | g |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 核电荷数 (单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
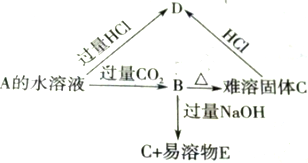 A、B、C、D、E 5种物质的转化关系如图所示.已知A为二元碱,微溶于水且溶解度随温度升高而降低
A、B、C、D、E 5种物质的转化关系如图所示.已知A为二元碱,微溶于水且溶解度随温度升高而降低查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
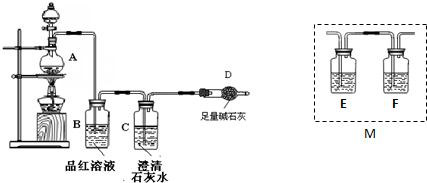
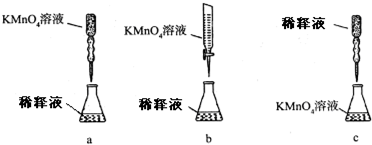
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com