
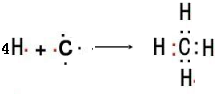 ,
,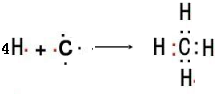 ;
;- 3 |
- 3 |
- 3 |
- 3 |
- 3 |
- 3 |


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
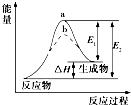
| A、催化剂能降低反应的活化能 |
| B、催化剂能改变反应的焓变 |
| C、该反应的反应热△H=E1-E2 |
| D、a、b分别对应有催化剂和无催化剂的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、Cl-离子的结构示意图: |
| B、HClO的结构式:H-O-Cl |
| C、丙烯的结构简式CH3CH2CH2 |
D、CCl4分子的球棍模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
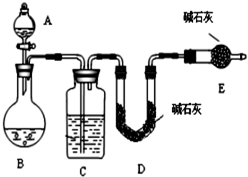 某化学兴趣小组采用下列方法测定Na2SO3样品中Na2SO4的质量分数
某化学兴趣小组采用下列方法测定Na2SO3样品中Na2SO4的质量分数查看答案和解析>>
科目:高中化学 来源: 题型:
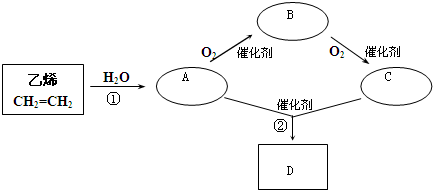
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com