
A、Cl-离子的结构示意图: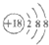 |
| B、HClO的结构式:H-O-Cl |
| C、丙烯的结构简式CH3CH2CH2 |
D、CCl4分子的球棍模型: |
 ,故A错误;
,故A错误;

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
| A、1:1 | B、3:2 |
| C、15:4 | D、5:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生铁、普通钢和不锈钢中的碳含量依次增加 |
| B、硅酸钠的水溶液俗称水玻璃,可用作木材防腐剂 |
| C、节日燃放的烟花是某些金属元素发生焰色反应所呈现出来的色彩 |
| D、明矾在自然水中生成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ag+、K+、NO3-、Cl- |
| B、Mg2+、Na+、Cl-、SO42- |
| C、Ca2+、Mg2+、OH-、Cl- |
| D、H+、Na+、CO32-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu溶于稀硝酸:Cu+2H++NO3-=Cu2++NO2↑+H2O | ||||
| B、向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3- | ||||
| C、(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓ | ||||
D、用CuCl2溶液做导电性实验,灯泡发光:CuCl2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向氧化镁中加入硫酸溶液 Mg2++SO42-═MgSO4 |
| B、向水中加入钠块 2Na+2H2O═2Na++2OH-+H2↑ |
| C、向氢氧化钡溶液中加入过量硫酸氢钠溶液 H++SO42-+Ba2++OH-═BaSO4↓+H2O |
| D、铁跟稀硫酸反应 2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
| A | 盐酸 | 泥水 | 食盐 | 氨水 |
| B | 苛性钾 | 碘酒 | 醋酸 | 干冰 |
| C | 石油 | 石灰石 | 磷酸 | 水 |
| D | 苏打 | 天然气 | 二氧化硫 | 酒精 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
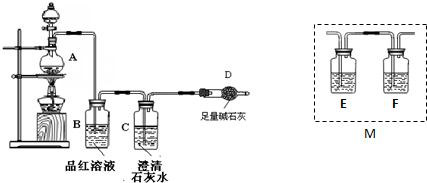
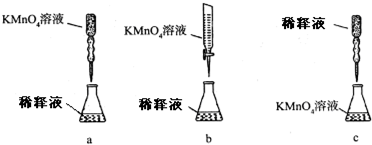
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com