
 ,
, ;
;


科目:高中化学 来源: 题型:
| A、向氧化镁中加入硫酸溶液 Mg2++SO42-═MgSO4 |
| B、向水中加入钠块 2Na+2H2O═2Na++2OH-+H2↑ |
| C、向氢氧化钡溶液中加入过量硫酸氢钠溶液 H++SO42-+Ba2++OH-═BaSO4↓+H2O |
| D、铁跟稀硫酸反应 2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
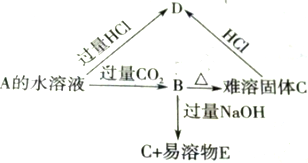 A、B、C、D、E 5种物质的转化关系如图所示.已知A为二元碱,微溶于水且溶解度随温度升高而降低
A、B、C、D、E 5种物质的转化关系如图所示.已知A为二元碱,微溶于水且溶解度随温度升高而降低查看答案和解析>>
科目:高中化学 来源: 题型:
| 色阶序号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 加入溶液B的体积(mL) | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 10.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
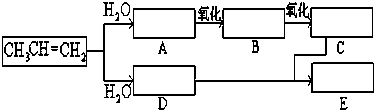
| 催化剂 |
| △ |
| 浓硫酸 |
| △ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com