
【题目】二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为11℃,可用于处理含硫废水。某小组在实验室中探究ClO2与Na2S的反应。回答下列问题:
(1)ClO2的制备:
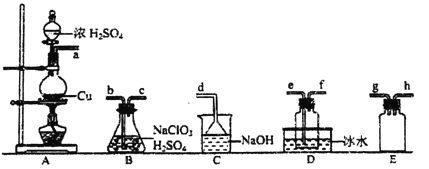
已知:SO2+2NaClO3+H2SO4=2ClO2↑+2NaHSO4
①装置A中反应的化学方程式为__________。
②欲收集ClO2,选择上图中的装置,其连接顺序为a→__________(按气流方向,用小写字母表示)。
③装置D的作用是___________________。
(2)C1O2与Na2S的反应

将上述收集到的ClO2用N2稀释以增强其稳定性,并将适量的稀释后的ClO2通入上图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究I中反应的产物。
操作步骤 | 实验现象 | 结论 |
取少量I中溶液于试管甲中,滴加品红溶液和盐酸。 | 品红始终不褪色 | ①无_________生成 |
另取少量I中溶液于试管乙中,加入Ba(OH)2溶液,振荡 | ②____________ | 有SO42-生成 |
③继续在试管乙中滴加Ba(OH)2溶液至过量,静置,取上层清液于试管丙中,_______。 | 有白色沉淀生成 | 有Cl-生成 |
④ClO2与Na2S的反应的离子方程式为______________,用于处理含硫废水时,ClO2相对于Cl2的优点是_________________(任写一条)。
【答案】 Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O g→h→b→c→e→f→d 冷凝并收集ClO2 SO2 有白色沉淀 加入足量稀硝酸酸化的AgNO3溶液 8ClO2+5S2-+4H2O=8Cl-+5SO42-+8H+ ClO2除硫效果彻底,氧化产物硫酸根稳定;ClO2在水中的溶解度大;剩余的ClO2不会产生二次污染,均被还原为Cl -时,二氧化氯得到的电子数是氯气的2.5 倍
CuSO4+SO2↑+2H2O g→h→b→c→e→f→d 冷凝并收集ClO2 SO2 有白色沉淀 加入足量稀硝酸酸化的AgNO3溶液 8ClO2+5S2-+4H2O=8Cl-+5SO42-+8H+ ClO2除硫效果彻底,氧化产物硫酸根稳定;ClO2在水中的溶解度大;剩余的ClO2不会产生二次污染,均被还原为Cl -时,二氧化氯得到的电子数是氯气的2.5 倍
【解析】试题分析:(1)①A装置中铜与浓硫酸反应生成硫酸铜、二氧化硫和水;②为防止倒吸,A中生成的二氧化硫通过E再与NaClO3、H2SO4发生反应生成二氧化氯;二氧化氯的沸点较低,可以用冰水冷凝收集,最后用氢氧化钠溶液进行尾气处理。③二氧化氯的沸点较低,可以用冰水冷凝并收集。(2)①品红始终不褪色说明没有SO2生成;②根据结论有SO42-生成,可知反应生成硫酸钡沉淀;③根据结论有Cl-生成,可知加入的试剂是硝酸银溶液;④ClO2与Na2S反应生成SO42-和Cl-;根据反应方程式分析优点。
解析:(1)①A装置中铜与浓硫酸反应生成硫酸铜、二氧化硫和水,反应方程式是Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;②为防止倒吸,A中生成的二氧化硫通过E再与NaClO3、H2SO4发生反应生成二氧化氯;二氧化氯的沸点较低,可以用冰水冷凝收集,最后用氢氧化钠溶液进行尾气处理,所以仪器的连接顺序是g→h→b→c→e→f→d。③二氧化氯的沸点较低,用冰水可以冷凝二氧化氯,所以D装置的作用是冷凝并收集ClO2。(2)①品红始终不褪色说明没有SO2生成;②根据结论有SO42-生成,可知反应生成硫酸钡,现象是有白色沉淀生成;③根据结论有Cl-生成,硝酸银和氯离子生成氯化银沉淀,可知加入的试剂是硝酸酸化的硝酸银溶液;④ClO2与Na2S反应生成SO42-和Cl-,反应方程式是8ClO2+5S2-+4H2O=8Cl-+5SO42-+8H+;ClO2相对于Cl2的优点是:ClO2除硫效果彻底,氧化产物硫酸根稳定;ClO2在水中的溶解度大;剩余的ClO2不会产生二次污染,均被还原为Cl-时,二氧化氯得到的电子数是氯气的2.5倍。
CuSO4+SO2↑+2H2O;②为防止倒吸,A中生成的二氧化硫通过E再与NaClO3、H2SO4发生反应生成二氧化氯;二氧化氯的沸点较低,可以用冰水冷凝收集,最后用氢氧化钠溶液进行尾气处理,所以仪器的连接顺序是g→h→b→c→e→f→d。③二氧化氯的沸点较低,用冰水可以冷凝二氧化氯,所以D装置的作用是冷凝并收集ClO2。(2)①品红始终不褪色说明没有SO2生成;②根据结论有SO42-生成,可知反应生成硫酸钡,现象是有白色沉淀生成;③根据结论有Cl-生成,硝酸银和氯离子生成氯化银沉淀,可知加入的试剂是硝酸酸化的硝酸银溶液;④ClO2与Na2S反应生成SO42-和Cl-,反应方程式是8ClO2+5S2-+4H2O=8Cl-+5SO42-+8H+;ClO2相对于Cl2的优点是:ClO2除硫效果彻底,氧化产物硫酸根稳定;ClO2在水中的溶解度大;剩余的ClO2不会产生二次污染,均被还原为Cl-时,二氧化氯得到的电子数是氯气的2.5倍。


科目:高中化学 来源: 题型:
【题目】人造地球卫星上使用的一种高能电池(银锌蓄电池),其电池的电极反应式为:Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-。据此判断氧化银是( )
A. 负极,被氧化B. 正极,被还原C. 负极,被还原D. 正极,被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在进行中和热的测定中,下列操作错误的是( )
A.反应前酸、碱溶液的温度要相同
B.测量溶液的温度计要一直插在溶液中
C.为了使反应均匀进行,可以向酸(碱)中分次加入碱(酸)
D.为了使反应更完全,可以使酸或碱适当过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是
A.Al(OH)3可制作胃酸中和剂
B.食盐中加入KIO3可以防治碘缺乏症
C.硅是良好的半导体材料,二氧化硅可用于制造光导纤维
D.葡萄酒中加入少量SO2,这是利用了SO2的漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,利用培养皿探究SO2的性质,实验时向Na2SO3固体上滴几滴浓硫酸,立即用另一表面扣在上面。表中对实验现象的描述或解释不正确的是

选项 | 实验现象 | 解释 |
A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了S单质 |
C | 酸性KMnO4溶液褪色 | SO2具有还原性 |
D | 品红溶液褪色 | SO2具有漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于在一定条件下密闭容器中进行的反应N2+3H2 ![]() 2NH3 , 下列有关推断正确的是( )
2NH3 , 下列有关推断正确的是( )
A.3molH2与足量的N2在该容器内充分反应可生成2molNH3
B.当生成N2和NH3的速率之比为1:2时反应处于平衡状态
C.在相同的温度和压强下,与不使用催化剂相比,使用催化剂可以提高平衡混合物中NH3的含量
D.当反应速率之比v(N2):v(H2):v(NH3)=1:3:2时,反应处于平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.48g铁铜合金完全溶解于80mL 4.0molL﹣1稀硝酸中,得到标准状况下672mL NO气体(假设此时无其他气体产生),下列说法正确的是( )
A.取反应后溶液,滴入几滴KSCN溶液,无血红色出现
B.该合金中铁与铜的物质的量之比是1:2
C.反应后溶液(忽略溶液体积变化)中c(H+)=2.5 molL﹣1
D.向反应后的溶液中加入2.0 molL﹣1NaOH溶液至金属离子恰好全部沉淀时,需加入NaOH溶液的体积是120 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com