
【题目】油脂是重要的营养物质。某天然油脂A可发生下列反应:
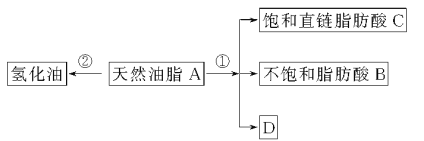
已知:A的分子式为C57H106O6。1 mol该天然油脂A经反应①可得到1 mol D、1 mol不饱和脂肪酸B和2 mol直链饱和脂肪酸C。经测定B的相对分子质量为280,原子个数比为C∶H∶O=9∶16∶1。
(1)写出B的分子式:______________。
(2)写出反应①的反应类型:______________;C的名称(或俗称)是______________。
(3)近日,电视媒体关于“氢化油危害堪比杀虫剂”的报道引发轩然大波,反应②为天然油脂的氢化过程。下列有关说法不正确的是______________。
a.氢化油又称人造奶油,通常又叫硬化油
b.植物油经过氢化处理后会产生副产品反式脂肪酸甘油酯,摄入过多的氢化油,容易堵塞血管而导致心脑血管疾病
c.氢化油的制备原理是在加热植物油时,加入金属催化剂,通入氢气,使液态油脂变为半固态或固态油脂
d.油脂的氢化与油脂的皂化都属于加成反应。
(4)D和足量金属钠反应的化学方程式:_______________。
【答案】(1)C18H32O2
(2)取代(或水解) 硬脂酸(或十八酸)(3)d
(4)2C3H5(OH)3+6Na―→2C3H5(ONa)3+3H2↑
【解析】(1)利用题给B分子中C、H、O原子个数比可得出B的最简式,然后利用B的相对分子质量可求出B的分子式为C18H32O2。(2)由转化关系可知反应①为油脂的水解反应(或取代反应),油脂为高级脂肪酸与甘油形成的酯,故可知D为甘油(C3H8O3),利用原子守恒,结合B的分子式与A的分子式可知,C的分子式为C17H35COOH,名称为硬脂酸。(3)油脂的皂化反应属于取代反应,故结合题给选项和有关信息可知d项说法不正确。(4)类比乙醇与Na的反应(金属钠可以置换出羟基中的H生成氢气),可知甘油D与足量金属钠反应的方程式。


 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
【题目】在200mLNa2CO3与NaAlO2的混合溶液中逐滴加入1molL﹣1的盐酸,测得溶液中的CO32﹣、HCO3﹣、AlO2﹣、Al3+离子的物质的量与加入盐酸溶液的体积变化关系,见下图一所示. 
(1)原混合溶液中Na2CO3的物质的量浓度为molL﹣1
(2)V1:V2= .
(3)若滴加盐酸过程中得到沉淀0.975g,则滴入盐酸的体积可能为mL.
(4)在图二坐标中画出该混合溶液中逐滴加入1molL﹣1的盐酸,所得沉淀的物质的量与加入盐酸溶液的体积变化关系. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)CH3OH(g)
(1)如表所列数据是该反应在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①该反应的熵变△S0 ( 填:“<,>,=”).该反应在(填:高温或低温)条件下能自发进行.
②要提高CO的转化率,可以采取的措施是(填序号).
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压
e.加入惰性气体加压 f.分离出甲醇
(2)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率AC(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数AC,由状态B到状态A,可采用的方法(填“升温”或“降温”). 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定.
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5molL﹣1 盐酸、0.55molL﹣1NaOH溶液,尚缺少的实验玻璃用品是、 .
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?(填“能”或“否”).
(3)他们记录的实验数据如下:已知:Q=Cm(t2﹣t1),反应后溶液的比热容C为4.18kJ℃﹣1kg﹣1 , 各物质的密度均为1gcm﹣3 . ①计算完成下表.(保留小数点后一位)
序号 | 实验用品 | 溶液温度 | 中和热△H | ||
t1 | t2 | ||||
① | 50mL0.55molL﹣1NaOH | 50mL0.55molL﹣1HCl | 20℃ | 23.3℃ | |
② | 50mL0.55molL﹣1NaOH | 50mL0.55molL﹣1HCl | 20℃ | 23.3℃ | |
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:
(4)若用KOH代替NaOH,对测定结果(填“有”或“无”)影响;若用醋酸代替HCl做实验,测定所得的中和热的数值将(填“变大”或“变小”或“无影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,溶液中由水电离产生的c(OH﹣)=1×10﹣14molL﹣1,满足此条件的溶液中一定能大量共存的离子组是
A. Al3+ Na+ CO32﹣ Cl﹣ B. K+ Ba2+ Cl﹣ NO3﹣
C. K+ Na+ Cl﹣ CO32﹣ D. K+ NH4+ SO42﹣ NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答以下问题:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 .
(2)另称取已去除表面氧化物的铁钉(碳素钢)6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y. ①甲同学认为X中除Fe3+外还可能含有Fe2+ . 写出生成Fe2+所有可能的离子方程式: .
②乙同学取336ml(标准状况)气体Y通入足量氯水中,发生反应的化学方程式为: .
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g.由于此推知气体Y中SO2的体积分数为 .
(3)向100ml水中投入Na和Al共16克,充分反应后剩余金属1g.计算放出H2的体积为升(标准状况下)
(4)向含有0.3mol NaAlO2的溶液中滴加1mol/L HCl,当生成7.8克沉淀时,加入盐酸的体积为mL
(5)向一定量的Fe、Fe2O3和CuO混合物投入120ml 2.2mol/L的硫酸溶液中,充分反应后生成896mL标准状况下的气体,得不溶物1.28g,过滤后,向滤液中加入2mol/L的NaOH溶液,加至40mL时开始出现沉淀,则滤液中FeSO4的物质的量浓度为(设滤液体积为120ml)mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电﹣Fenton法是用于水体里有机污染物降解的高级氧化技术,其反应原理如图所示,其中电解产生的H2O2与Fe2+发生Fenton反应:Fe2++H2O2=Fe3++OH﹣+OH,生成的烃基自由基(OH)能氧化降解有机污染物.下列说法不正确的是( ) 
A.电源的A极是负极
B.电解池中只有O2、Fe3+发生还原反应
C.阳极上发生电极反应:H2O﹣e﹣=OH+H+ ,
D.消耗1molO2 , 可以产生4molOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物含有C、H、O、N四种元素,下图是该有机物的球棍模型:
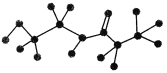
(1)该有机物的分子式为________,结构简式为__________________。
(2)该有机物可能发生的反应有________(填编号)。
①取代反应 ②消去反应 ③加聚反应 ④氧化反应 ⑤酯化反应 ⑥缩聚反应
(3)该有机物发生水解反应的化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)pH=2的某酸稀释100倍,pH________4,pH=12的某碱稀释100倍,pH________10。
(2)室温时,将pH=5的H2SO4溶液稀释10倍,c(H+)∶c(SO42-)=________,将稀释后的溶液再稀释100倍,c(H+)∶c(SO42-)=________。
(3)
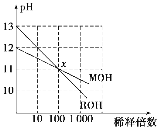
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如上图所示。下列叙述中不正确的是( )
A.MOH是一种弱碱
B.在x点,MOH完全电离
C.在x点,c(M+)=c(R+)
D.稀释前ROH溶液中c(OH-)是MOH溶液中c(OH-)的10倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com