
����Ŀ����200mLNa2CO3��NaAlO2�Ļ����Һ����μ���1molL��1�����ᣬ�����Һ�е�CO32����HCO3����AlO2����Al3+���ӵ����ʵ��������������Һ������仯��ϵ������ͼһ��ʾ�� 
��1��ԭ�����Һ��Na2CO3�����ʵ���Ũ��ΪmolL��1
��2��V1��V2= ��
��3�����μ���������еõ�����0.975g�������������������ΪmL��
��4����ͼ�������л����û����Һ����μ���1molL��1�����ᣬ���ó��������ʵ��������������Һ������仯��ϵ�� 
���𰸡�
��1��0.25
��2��1��4
��3��12.5��262.5
��4��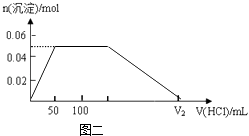
���������⣺Na2CO3��NaAlO2�Ļ����Һ����μ���1molL��1�����ᣬ�ȷ�����Ӧ��AlO2��+H++H2O�TAl��OH��3����a�߱�ʾAlO2�� �� ��ͼ��֪AlO2����Ӧ��ϣ���������50mL�����ݷ���ʽ��֪n��AlO2����=n��H+��=0.05L��1mol/L=0.05mol�� �ڶ��Σ�AlO2����Ӧ��ϣ�������Ӧ��CO32��+H+�THCO3�� �� b�߱�ʾCO32�� �� c�߱�ʾHCO3�� �� ��ͼ��֪CO32����Ӧ��ϣ��ýμ�������100mL��50mL=50mL�����ݷ���ʽ��֪n��CO32����=n��H+��=0.05L��1mol/L=0.05mol��
�����Σ�CO32����Ӧ��ϣ�������Ӧ��HCO3��+H+�TCO2��+H2O��d�߱�ʾHCO3�� �� ��ͼ��֪HCO3����Ӧ��ϣ��ýμ�������150mL��100mL=50mL�����ݷ���ʽ��֪n��HCO3����=n��H+����
���ĽΣ�������ӦAl��OH��3+3H+�TAl3++3H2O��e�߱�ʾAl3+ �� ��ͼ��֪Al��OH��3��Ӧ��ϣ����ݷ���ʽ��֪n��H+��=3n[Al��OH��3]=3��0.05mol=0.15mol���ýμ����������Ϊ�� ![]() =0.15L=150mL��1�����ݷ�����֪��n��CO32����=n��H+��=0.05L��1mol/L=0.05mol����c��CO32����=
=0.15L=150mL��1�����ݷ�����֪��n��CO32����=n��H+��=0.05L��1mol/L=0.05mol����c��CO32����= ![]() =00.25 molL��1 ��
=00.25 molL��1 ��
���Դ��ǣ�0.25����2��ԭ��Һ��n��CO32����=0.05mol��V1ʱ��Һ��̼��������ӵ���̼�������Ϊ0.025ml���ɷ�ӦCO32��+H+�THCO3����֪����Ҫ����Ϊ0.025mol����������Ϊ ![]() =0.025L=25mL����V1=50mL+25mL=75mL��������������֪��V2=150mL+150mL=300mL����V1��V2=75mL��300mL=l��4�����Դ��ǣ�1��4����3��0.975g�����������������ʵ���Ϊ��
=0.025L=25mL����V1=50mL+25mL=75mL��������������֪��V2=150mL+150mL=300mL����V1��V2=75mL��300mL=l��4�����Դ��ǣ�1��4����3��0.975g�����������������ʵ���Ϊ�� ![]() =0.0125mol�����ɵij�������Ϊ��ʼʱֻ������ӦAlO2��+H++H2O�TAl��OH��3�����ɵģ�������0.0125mol��������������Ҫ����0.0125mol�����ӣ���Ҫ������������Ϊ��
=0.0125mol�����ɵij�������Ϊ��ʼʱֻ������ӦAlO2��+H++H2O�TAl��OH��3�����ɵģ�������0.0125mol��������������Ҫ����0.0125mol�����ӣ���Ҫ������������Ϊ�� ![]() =0.0125L=12.5mL�����ɵ�0.0125mol�������������п���Ϊ���Ľ�ʣ�����������������ͼ���֪��������������������������150mL������������������ʵ���Ϊ0.05mol����Ӧʣ�����������Ϊ0.0125mol������Ҫ�ܽ���������������ʵ���Ϊ��0.05mol��0.0125mol=0.0375mol�����ݷ�ӦAl��OH��3+3H+�TAl3++3H2O��֪���ܽ�0.0375mol����������Ҫ�����Ȼ�������ʵ���Ϊ��0.0375mol��3=0.1125L=112.5mL�������ܹ�������������Ϊ��150mL+112.5mL=262.5mL�����Դ��ǣ�12.5mL ��262.5mL����4�����ݷ�����֪��������50mL����ʱ������0.05mol��������������֮�������������������ʵ�����ʱ���䣬������150mL�������������������ʼ�ܽ⣬ֱ������300mL����ʱ����������ȫ�ܽ⣬�ݴ˻������ó��������ʵ��������������Һ������仯��ϵ��ͼ��Ϊ��
=0.0125L=12.5mL�����ɵ�0.0125mol�������������п���Ϊ���Ľ�ʣ�����������������ͼ���֪��������������������������150mL������������������ʵ���Ϊ0.05mol����Ӧʣ�����������Ϊ0.0125mol������Ҫ�ܽ���������������ʵ���Ϊ��0.05mol��0.0125mol=0.0375mol�����ݷ�ӦAl��OH��3+3H+�TAl3++3H2O��֪���ܽ�0.0375mol����������Ҫ�����Ȼ�������ʵ���Ϊ��0.0375mol��3=0.1125L=112.5mL�������ܹ�������������Ϊ��150mL+112.5mL=262.5mL�����Դ��ǣ�12.5mL ��262.5mL����4�����ݷ�����֪��������50mL����ʱ������0.05mol��������������֮�������������������ʵ�����ʱ���䣬������150mL�������������������ʼ�ܽ⣬ֱ������300mL����ʱ����������ȫ�ܽ⣬�ݴ˻������ó��������ʵ��������������Һ������仯��ϵ��ͼ��Ϊ��  �����Դ��ǣ�
�����Դ��ǣ�  ��
��


 ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д�
ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д� â���̸����������������ϵ�д�
â���̸����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£���һ���������ܱ������г���2mol A��1mol B���������з�Ӧ��
2A��g��+B��g��2C��g����H��0���ﵽƽ�����t1ʱ�̸ı���������ѧ��Ӧ������ʱ��仯��ͼ�����ж�t1ʱ�̸ı��������Ʋ�����ȷ���ǣ� ��
A.����ѹǿ���䣬���߷�Ӧ�¶�
B.�����¶Ȳ��䣬�����������
C.�����¶Ⱥ�����������䣬����1 mol C��g��
D.�����¶Ⱥ�ѹǿ���䣬����1 mol C��g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��T��ʱ����һ�����Ϊ2L�������У�A������B���巴Ӧ����C���壬��Ӧ������A��B��CŨ�ȱ仯��ͼ��ʾ�� 
��1��д���÷�Ӧ�ķ���ʽ����
��2��0��4�����ڼ䣬B��ƽ����Ӧ����Ϊ����
��3������ƽ��ʱB��ת����Ϊ����
��4����֪��K��300�棩��K��350�棩���÷�Ӧ���ȷ�Ӧ��
��5�����������£����д�ʩ����ʹ ![]() ���͵���
���͵���
a�����뺤�� b�������¶� c��ʹ�ô��� d���ٳ���2.4mol A��1.6mol B��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���ijһԪ��HA��NaOH��Һ�������ϣ�������Һ��Ũ�Ⱥͻ�Ϻ�������Һ��pH���±���
ʵ�� ��� | HA���ʵ��� Ũ��(mol/L) | NaOH���ʵ��� Ũ��(mol/L) | �����Һ��pH |
�� | 0.1 | 0.1 | pH��9 |
�� | c | 0.2 | pH��7 |
�� | 0.2 | 0.1 | pH<7 |
��ش�
(1)�Ӣ������������HA��__________(�ǿ�ᡱ�����ᡱ)��
(2)�������������c__________(�>������<������)0.2 mol/L�����Һ������Ũ��c(A��)��c(Na��)�Ĵ�С��ϵ��__________��
(3)�Ӣ���ʵ����������˵��HA�ĵ���̶�__________(�>������<������)NaA��ˮ��̶ȣ��û����Һ������Ũ���ɴ�С��˳����__________________��
(4)����ʵ�����û����Һ����ˮ�������c(OH��)��________mol��L��1��д���û����Һ��������ʽ�ľ�ȷ���(���ܽ��Ƽ���)��
c(Na��)��c(A��)��________mol��L��1��
c(OH��)��c(HA)��________mol��L��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������仯�����ڹ��á��ճ�������ռ�зdz���Ҫ�ĵ�λ����ش��������⣺
��1��������Ȼ������̬������롱���ϡ������ڣ������������г�������ɫ�����Ϳ�ϵ������ѧʽ�������������������ڸ����·�Ӧ�Ļ�ѧ����ʽΪ��
��2�������ӷ���ʽ��ʾ��ȥ�����л��е�������
��3��д������FeCl3������Һ����ڵ�����ˮ�Ʊ�������������Ļ�ѧ����ʽ����
��4�����FeCl3��Һ���Ƿ���������FeCl2�IJ�����������
��5����֪t��ʱ��FeO��s��+CO��g��Fe��s��+CO2��g����ƽ�ⳣ��K=0.25���ڸ��¶��£���Ӧ�ﵽƽ��ʱn��CO����n��CO2��= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����հ���٤�����ɣ�����������ȷ���� �� ��
A. ͬ��ͬѹ��������������֮�ȵ���Ħ������֮��
B. ͬ��ͬѹ��������������ʵ���֮�ȵ����ܶ�֮��
C. ͬ��ͬѹ�����������Ħ������֮�ȵ����ܶ�֮��
D. ͬ��ͬ�����������������ʵ���֮�ȵ���ѹǿ�ķ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������и�װ��ͼ�������У�����ȷ���ǣ� �� 
A.��װ�âپ���ͭ����a��Ϊ��ͭ���������ҺΪCuSO4��Һ
B.��װ�âٽ��е�ƣ��Ƽ�����b����
C.װ�âڵ��ܷ�Ӧ�ǣ�Cu+2Fe3+�TCu2++2Fe2+
D.װ�â��е���������û����ʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʣ�ǰ��Ϊǿ����ʣ�����Ϊ�ǵ���ʵ��ǣ� ��
A.���ᡢ����
B.���Լء���������
C.�Ȼ��⡢���ʯ
D.�Ȼ��ơ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֬����Ҫ��Ӫ�����ʡ�ij��Ȼ��֬A�ɷ������з�Ӧ��
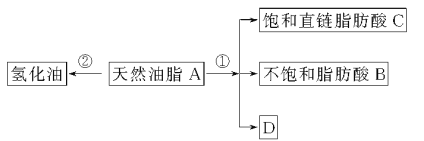
��֪��A�ķ���ʽΪC57H106O6��1 mol����Ȼ��֬A����Ӧ�ٿɵõ�1 mol D��1 mol������֬����B��2 molֱ������֬����C�����ⶨB����Է�������Ϊ280��ԭ�Ӹ�����ΪC��H��O��9��16��1��
(1)д��B�ķ���ʽ��______________��
(2)д����Ӧ�ٵķ�Ӧ���ͣ�______________��C������(���׳�)��______________��
(3)���գ�����ý����ڡ��⻯��Σ������ɱ������ı���������Ȼ����Ӧ��Ϊ��Ȼ��֬���⻯���̡������й�˵������ȷ����______________��
a���⻯���ֳ��������ͣ�ͨ���ֽ�Ӳ����
b��ֲ���;����⻯��������������Ʒ��ʽ֬��������������������⻯�ͣ�������Ѫ�ܶ���������Ѫ�ܼ���
c���⻯�͵��Ʊ�ԭ�����ڼ���ֲ����ʱ���������������ͨ��������ʹҺ̬��֬��Ϊ���̬���̬��֬
d����֬���⻯����֬�����������ڼӳɷ�Ӧ��
(4)D�����������Ʒ�Ӧ�Ļ�ѧ����ʽ��_______________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com