
(14分)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和l00g 10.00%的K2SO4溶液.电极均为石墨电极。
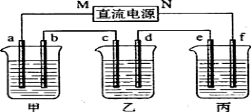
(1)接通电源,经过一段时间后,测得e电极上收集到气体在标准状况下体积为4.48L,乙中c电极质量增加。据此回答问题:
①电源的N端为 极。
②电极b上发生的电极反应为
③电解前后甲溶液 pH ;乙溶液 pH ;丙溶液 pH 。(填“变大”、“ 变小”或“不变”)
④电极b上生成的气体在标准状况下的体积 ;电极c的质量变化是 g。
(2)写出乙溶液中的电解反应方程式: 需加入 g (填物质名称)复原。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016届贵州省贵阳市高三8月摸底考试化学试卷(解析版) 题型:选择题
从2009年的生态文明贵阳会议开始,生态文明贵阳会议逐渐上升为国家级的生态文明国际论坛,下列说法与贵阳创建生态文明城市不相符的是
A.启用大气中细颗粒物(PM2.5)的监测系统,以追根溯源,采取措施,改善空气质量
B.开发高效氢能、太阳能等新型电动汽车,以解决城市机动车尾气排放问题
C.推广使用可降解塑料及布质购物袋,以减少“白色污染”
D.目前我市的汽油标准已由“国III”提升到“国IV”,这意味着汽车不再排放氮氧化物
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三上学期第一次月考化学试卷(解析版) 题型:填空题
(12分)实验室用碳酸钠晶体配制1.00 mol·L-1的Na2CO3溶液80 mL,回答下列问题:
(1)本实验需称量碳酸钠晶体(Na2CO3·10H2O)的质量为 g。
(2)应选用 mL容量瓶。
(3)某同学将称量好的碳酸钠晶体用适量的蒸馏水在烧杯中溶解,冷却后,直接倒入经检查不漏水的容量瓶中,洗涤烧杯和玻璃棒各2~3次,洗涤液也移至容量瓶中,然后加水至距刻度线1~2 cm处,用胶头滴管加蒸馏水至刻度线,然后将溶液转入试剂瓶中。指出上述操作中的3个错误。
① ;
② ;
③ 。
(4)配制上述溶液,造成所配溶液浓度偏低的原因是 。
 A.称量碳酸钠晶体(Na2CO3·10H2O)的时间太长,且暴露在空气中
A.称量碳酸钠晶体(Na2CO3·10H2O)的时间太长,且暴露在空气中
B.向容量瓶转移液体时,容量瓶事先用蒸馏水洗涤
C.定容时俯视刻度线
D.洗涤液移至容量瓶中时洒出一部分
查看答案和解析>>
科目:高中化学 来源:2015-2016学年北京大学附属中学分校高二上抽考化学试卷(解析版) 题型:选择题
已知2H2(g)+O2(g)=2H2O(l);ΔH=-571.6kJ/mol,CO(g)+O2(g)=CO2(g);ΔH=-282.9kJ/mol某H2和CO的混合气体完全燃烧时放出113.74kJ热量,同时生成3.6g液态水,则原混合气体中H2和CO的物质的量之比为
A.1∶1 B.1∶2 C.2∶1 D.2∶3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高一上期中测试化学试卷(解析版) 题型:填空题
(8分)有一包白色固体,可能含有CaCO3、Na2SO4、KNO3、CuSO4、BaCl2五种物质中的一种或几种。现进行如下实验:
①取少量固体粉末,加入盛有足量水的烧杯中,充分搅拌静置后,底部白色沉淀,上层为无色溶液;
②继续往烧杯中加入足量稀硝酸,白色沉淀完全消失;并有气泡产生。
③取少量②中溶液滴加Ba(NO3)2溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶解。
(1)根据以上实验现象可知,该白色固体中一定含有 ,(填化学式,下同)一定不含有 ,可能含有 。
(2)上述实验②过程中所发生反应的离子方程式为:
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东寿光中学高一上10月月考化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的值,下列关于0.2mol·L-1的Ba(NO3)2溶液的说法不正确的是
A.2L溶液中有阴、阳离子总数为1.2NA
B.500mL溶液中NO3-离子浓度为0.2mol·L-1
C.500mL溶液中Ba2+离子浓度为0.2mol·L-1
D.500mL溶液中NO3-离子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高一上期中测试化学试卷(解析版) 题型:选择题
下列化学反应中,属于氧化还原反应的是
A.NaOH+HCl═NaCl+H2O B.2FeCl2+Cl2═2FeCl3
C.H2CO3═H2O+CO2 D.NH3+HCl═NH4Cl
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃兰州一中高二上期中测试理科化学试卷(解析版) 题型:填空题
(14分)甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g) CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
化学键 | H-H | C-O | C≡O | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
(1)已知反应①中的相关的化学键键能数据如下:
由此计算△H1= kJ.mol-1,已知△H2=-58kJ.mol-1,则△H3= kJ.mol-1
(2)反应①的化学平衡常数K的表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。
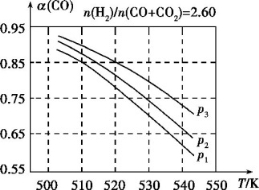
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而 (填“增大”或“减小”),其原因是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁实验中学高一上10月阶段测化学试卷(解析版) 题型:选择题
选取萃取剂将碘水中的碘萃取出来,这种萃取剂应具备的性质是
A.不溶于水,且必须易与碘发生化学反应
B.不溶于水,比水更容易使碘溶解 ,且不能与碘发生化学反应
C.不溶于水,且必须比水密度大
D.不溶于水,且必须比水密度小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com