

| ||
| 112g |
| 160g/mol |
| 112g |
| 160g/mol |
| 112g |
| 160g/mol |
| 250 |
| 25 |
| 112g |
| 160g/mol |
| 500 |
| 50 |
| ||
| 112g |
| 160g/mol |
| 112g |
| 160g/mol |
| 112g |
| 160g/mol |
| 250 |
| 25 |
| 112g |
| 160g/mol |
| 500 |
| 50 |
| m(Fe) |
| m(样品) |
| 30.8g |
| 56.0g |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
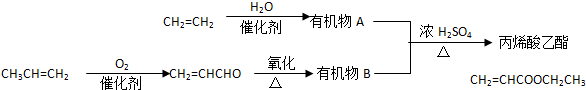
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-=4OH- |
| B、Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+ |
| C、Ⅰ和Ⅱ中正极均被保护 |
| D、Ⅰ和Ⅱ中分别加入少量K3Fe(CN)6溶液,均有蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
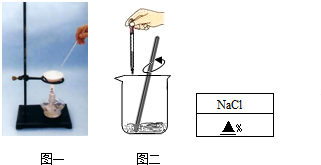
| 蒸发皿的质量 | 蒸发皿的质量+食盐溶液的质量 | 蒸发皿的质量+食盐晶体的质量 |
| 28.8克 | 48.8克 | 30.7克 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 实验步骤 | 简述实验操作(不必叙述如何组装实验装置) |
| ① | 溶解 | 将混合物放入烧杯中,加入98%H2SO4,充分搅拌直至固体不再溶解 |
| ② | ||
| ③ | ||
| ④ | ||
| ⑤ | 洗涤沉淀 | |
| ⑥ | 检验沉淀是否洗净 |
查看答案和解析>>
科目:高中化学 来源: 题型:


| SOCl2 |
| R?OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 实验测定化学反应速率 |
B、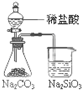 能证明非金属性 Cl>C>Si |
C、 实验制取并收集NH3 |
D、 滴定法测定盐酸浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com