
| A、c(HA)>c(HB) |
| B、c(A-)>c(B-) |
| C、c(H+)>c(OH-) |
| D、c(A-)+c(B-)>c(Na+) |


科目:高中化学 来源: 题型:
| A、4.4g |
| B、1.4g |
| C、2.2g |
| D、在2.2g和4.4g之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:
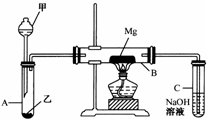 已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.
已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将10.6gNa2CO3溶于100mL水中 |
| B、将28.6g Na2CO3?10H2O溶于少量水中,再用水稀释至100mL |
| C、将20mL5.0mol/L Na2CO3溶液用水稀释至100mL |
| D、在20mL5.0mol/L Na2CO3溶液中加入80mL水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
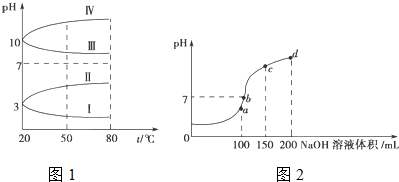
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究.
影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究.| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中 ② | 反应速率Mg>Fe, Cu不反应 | 金属的性质越活泼, 反应速率越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
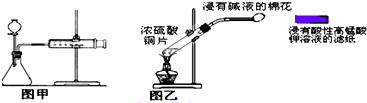
| A、快速分离氢氧化铁胶状沉淀和氯化钠溶液可用抽滤法 |
| B、常温下,苯酚与水形成的浊液静置后会分层,上层为溶有水的苯酚溶液 |
| C、甲装置可用于某些化学反应速率的测定.该装置气密性的检查如下:仪器组装好后,关闭分液漏斗活塞,将针筒活塞向外拉一段距离,然后松手,观察针筒是否能回到原来刻度处 |
| D、乙装置可用来制取和检验二氧化硫气体漂白性,待滤纸颜色褪去后立即用浸有碱液的棉花堵住试管口 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com