
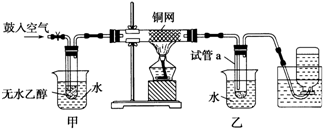
| Cu |
| △ |
| ||
| 放热 |
| △ |
| ||
| 放热 |
| △ |


科目:高中化学 来源: 题型:
| A、①② | B、③④ |
| C、②③④ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素符号 | Li | Be | B | C | O | F |
| x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 |
| 元素符号 | Na | Al | Si | P | S | Cl |
| x值 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
查看答案和解析>>
科目:高中化学 来源: 题型:
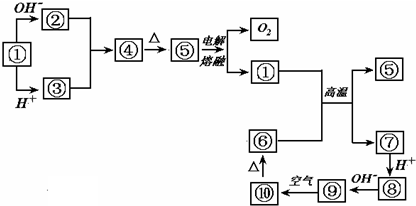
查看答案和解析>>
科目:高中化学 来源: 题型:
| 标准状况V(CO2)/L | 所得固体组成(填化学式) | 所得固体质量m/g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Na | Mg | Al | ||
| 与冷水反应 | 现象 | |||
| 化学方程式 | ||||
| 与沸水反应 | 现象 | |||
| 化学方程式 | ||||
| 结论 | ||||
| 最高价氧化物对应的水化物碱性强弱 | NaOH | Mg(OH)2 中强酸 | Al(OH)3 | |
| Mg | Al | |
| 现象 | ||
| 反应方程式 |
| Si | P | S | Cl | |
| 单质与氢气反应的条件 | 高温 | 磷蒸气与氢气能反应 | 加热 | 光照或点燃时发生爆炸而化合 |
| 最高价氧化物对应的水化物(含氧酸)酸性强弱 | H2SiO3 弱酸 | H3PO4 中强酸 | H2SO4 强酸 | HClO4 强酸 (比H2SO4酸性强) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com