
【题目】太阳能电池板材料除单品硅外,还有铜、铟、稼、硒、硅等化学物质。
(1)硒、硅与氢元素形成的组成最简单的氢化物中,若“Si-H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se____Si(填“>”、“<”)。人们把硅与氢元素形成的一类化合物叫硅烷(SinH2n+2)。硅烷的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是______________。

(2)①已知高温下CuO→Cu2O+O2,从铜原子价层电子结构(3d 和4s轨道上应填充的电子数)变化角度来看,能生成Cu2O的原因是___________。
② 金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子方程式为___________________。
③ 铜晶体为面心立方最密堆积,铜的原子半径为127.8pm,计算晶体铜的密度_____g/cm3。
(3)稼的基态原子的电子排布式是_______。与铟、稼元家处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成配合物.如BF3能与NH3反应生成BF3·NH3。BF3·NH3中B原子的杂化轨道类型为______,B与N之间形成______键;硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质.其电离方程式为______________。
【答案】 > 硅烷为分子晶体,随相对分子质量增大,分子间作用力增强,熔沸点升高 CuO中铜的价层电子排布为3d94s0,Cu2O中铜的价层电子排布为3d10,后者处于稳定的全充满状态而前者不是 Cu+H2O2+4NH3·H2O===Cu(NH3) 42++2OH-+4H2O 9.0 g·cm-3 1s22s22p63s23p63d104s24p1(或3d104s24p1) sp3 配位 H3BO3+H2O![]() [B(OH)4]-+H+
[B(OH)4]-+H+
【解析】(1)若“Si-H”中键合电子偏向氢原子,说明硅显正价,氢气与硒反应时单质硒是氧化剂,硒显负价,所以硒与硅的电负性相对大小为Se>Si;硅烷(SinH2n+2)都是分子晶体,分子晶体的沸点高低取决于分子间作用力,而分子间作用力与相对分子质量的大小有关,硅烷的相对分子质量越大,分子间范德华力越强;
(2)①Cu2+的价电子结构为3d9,Cu+的价电子结构为3d10,3d10为稳定结构,所以在高温时,Cu2+得一个电子变成稳定结构的Cu+;
② Cu被 H2O2 氧化成Cu2+ ,Cu2+与氨水形成络合物Cu(NH3)4(OH)2,反应的离子方程式为Cu+H2O2+4NH3·H2O===Cu(NH3) 42++2OH-+4H2O;
③ 晶胞为面心立方密堆积,晶胞面对角线上的Cu原子相邻,则晶胞棱长为127.8pm×4×![]() =
=![]() ×127.8pm,晶胞中Cu原子数目为8×
×127.8pm,晶胞中Cu原子数目为8×![]() +6×
+6×![]() =4,晶胞质量为4×
=4,晶胞质量为4×![]() g,则晶胞密度4×
g,则晶胞密度4×![]() g÷(
g÷(![]() ×127.8×10-10 cm)3=
×127.8×10-10 cm)3=![]() gcm-3=9.0 g·cm-3 ;
gcm-3=9.0 g·cm-3 ;
(3)稼的核电荷数是31,其基态原子的电子排布式是1s22s22p63s23p63d104s24p1(或3d104s24p1);BF3NH3中B原子含有3个σ 键和1个配位键,所以其价层电子数是4,B原子采取sp3杂化,该化合物中,B原子提供空轨道的原子、N原子提供孤电子对,所以B、N原子之间形成配位键;硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质,其电离方程式为H3BO3+H2O![]() [B(OH)4]-+H+。
[B(OH)4]-+H+。


科目:高中化学 来源: 题型:
【题目】在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50%
B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C. 增大压强使平衡向生成Z的方向移动,平衡常数增大
D. 改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量的工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。
乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体。由此他提出必须先除去杂质,再与溴水反应。请回答下列问题:
(1)写出甲同学实验中两个主要的化学方程式:____________________。
(2)甲同学设计的实验________(填“能”或“不能”)验证乙炔与溴发生加成反应,其理由是________。
a.使溴水褪色的反应,未必是加成反应
b.使溴水褪色的反应,就是加成反应
c.使溴水褪色的物质,未必是乙炔
d.使溴水褪色的物质,就是乙炔
(3)乙同学推测此乙炔中必定含有的一种杂质气体是___________,它与溴水反应的化学方程式是___________________,在验证过程中必须全部除去。
(4)请你选用下列四个装置(见下图,可重复使用)来实现乙同学的实验方案,将它们的编号填入方框,并写出装置内所放的化学药品。
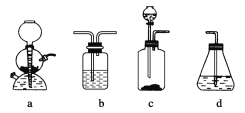
(5)为验证这一反应是加成而不是取代,丙同学提出可用pH试纸来测试反应后溶液的酸性。理由是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】紫杉醇是一种新型抗癌药,其分子式为C47H51NO14,它是由如下的A酸和B醇生成的一种酯。
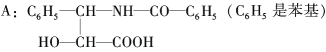
B:R-OH(R是一个含C、H、O的基团)
(1)A可在无机酸催化下水解,其反应方程式是_______________________。
(2)A水解所得的氨基酸不是天然蛋白质水解产物,因为氨基不在(填希腊字母)________位。
(3)写出ROH的分子式:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一块铝箔,用砂纸打磨表面后,在酒精灯上加入熔化,下列说法正确的是
A. 铝箔燃烧 B. 熔化的是Al2O3 C. 熔化物滴落 D. 熔化物不滴落
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三支试管中分别盛有含Cl- 、Br-、I-的溶液,向试管A中加入淀粉溶液和新制的氯水,使溶液变为橙黄色;再将此溶液倒入试管C中,无明显现象。A、B、C三支试管中所含有的离子依次是
A. I-、Br-、Cl- B. Br-、Cl-、I- C. Cl-、I-、Br- D. Br-、I-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硅酸的反应为Na2SiO3+2HCl=2NaCl+ H2SiO3↓,该反应属于
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的恒容容器中,充入1molA和3molB,并在一定条件下发生如下反应:
A(s)+3B(g)![]() 2C(g)
2C(g)
若经3s后测得C的浓度为0.6molL-1,下列选项说法正确的组合是
①用A表示的反应速率为0.1molL-1s-1
②用B表示的反应速率为0.4molL-1s-1
③3s时生成C的物质的量为1.2 mol
④3s时B的浓度为0.6molL-1
A.①②④ B.①③④ C.③④ D.②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com