
| 阳离子 | Na+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl-、OH-、CO32-、SO42- |
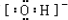 ,B中阳离子为Ba2+,故答案为:
,B中阳离子为Ba2+,故答案为: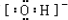 ;Ba2+;
;Ba2+; 

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:
| A、2NO2(g)?N2O4(g) (正反应为放热反应) |
| B、3O2 (g)?2O3(g) (正反应为吸热反应) |
| C、H2(g)+I2(g)?2 H I(g)(正反应为放热反应) |
| D、NH4HCO3(s)?NH3(g)+H2O(g)+CO2(g) (正反应为吸热反应) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察下图,然后回答问题.
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察下图,然后回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
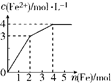 在Fe(NO3)3和Cu(NO3)2的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示.则该溶液中Fe(NO3)3与Cu(NO3)2的物质的量浓度之比为( )
在Fe(NO3)3和Cu(NO3)2的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示.则该溶液中Fe(NO3)3与Cu(NO3)2的物质的量浓度之比为( )| A、3:1 | B、1:2 |
| C、2:1 | D、1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com