
【题目】根据以下三个实验:①铁钉放入硫酸铜溶液中 ②铜丝放入氯化铁溶液中 ③铜丝放入稀硝酸中,下列判断正确的是( )
A.实验①③中硫酸铜、稀硝酸都只做氧化剂
B.实验①②中发生的都是置换反应
C.实验③中可收集到NO、H2的混合气体
D.上述实验证明氧化性:稀硝酸>Cu2+>Fe2+
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:
【题目】如图是实验室制取纯净氯气的装置图,下列说法正确的是( )
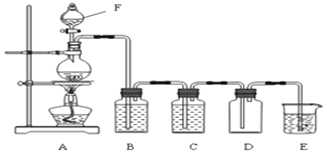
A.分液漏斗中盛装的是浓硫酸
B.B的目的是为了除去氯气中的水分
C.E的目的是为了处理过量的氯气,E中盛装的是Ca(OH)2溶液
D.D广口瓶除了可以用于收集气体外,还可以用做安全瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知亚磷酸(H3PO3)的结构如图![]() ,具有强还原性的二元弱酸,可以被银离子氧化为磷酸。
,具有强还原性的二元弱酸,可以被银离子氧化为磷酸。
(1)已知亚磷酸可由PCl3水解而成,请写出相应的方程式___;
(2)Na2HPO3是________(填“正盐”或“酸式盐”);
(3)亚磷酸与银离子反应时氧化剂与还原剂的物质的量之比为______________;
(4)某温度下,0.10molL-1的H3PO3溶液的pH为1.6,即c(H+)=2.5×10-2molL-1,该温度下H3PO3的一级电离平衡常数Ka1=______;(H3PO3第二步电离忽略不计,结果保留两位有效数字)
(5)向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中:c(Na+)_____c(H2PO3-)+2c(HPO32-)(填“>”、“<”或“=”);
(6)向某浓度的亚磷酸中滴加NaOH溶液,其pH与溶液中的H3PO3、H2PO3—、HPO32—的物质的量分数a(X)(平衡时某物种的浓度与整个物种浓度之和的比值)的关系如图所示。
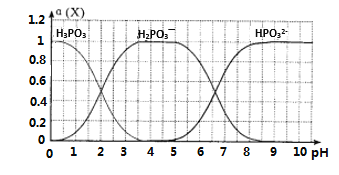
以酚酞为指示剂,当溶液由无色变为浅红色时,发生主要反应的离子方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是( )
A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】橡胶行业是国民经济的重要基础产业之一,在现代生产、军事工业、医疗行业中有广泛应用。如图是生产合成橡胶G和医用高分子材料C的路线图,已知B的分子式为C6H10O3。请回答下列问题:
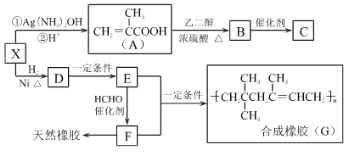
(1)X中的含氧官能团名称是___,X的核磁共振氢谱有___组峰。
(2)A→B的反应类型是___。
(3)C的结构简式是___。
(4)X发生银镜反应的化学方程式为___。
(5)写出E→F的化学反应方程式___。
(6)A有多种同分异构体,其中属于酯类且含有碳碳双键的共有___种(不含立体异构)。
(7)已知:①![]() ②
②![]() +SOCl2→
+SOCl2→![]() +SO2+HCl。请将下列以
+SO2+HCl。请将下列以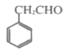 为原料制备
为原料制备 的合成路线流程图补充完整___(无机试剂任用)。
的合成路线流程图补充完整___(无机试剂任用)。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分弱酸的电离平衡常数如表:
弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
电离平衡 常数(25℃) | Ka=1.77×10-4 | Ka=4.0×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)室温下①0.1mol·L-1HCOONa;②0.1mol·L-1NaClO;③0.1mol·L-1Na2CO3;④0.1mol·L-1NaHCO3四种溶液的pH由大到小的关系为________________。(用序号填空)
(2)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为________________。
(3)下列离子方程式正确的是___________(填字母)。
A.2ClO-+H2O+CO2=2HClO+CO32- B.2HCOOH+CO32-=2HCOO-+H2O+CO2↑
C.H2SO3+2HCOO-=2HCOOH+SO32- D.Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-
(4)某温度(T℃)下的溶液中,c(H+)=10-xmol·L-1,c(OH-=10-ymol·L-1,x与y的关系如图所示。
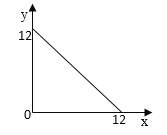
①此温度下,0.01mol/L的NaOH溶液中水电离出的OH-浓度为_______。
②在此温度下,0.1mol·L-1的NaHSO4溶液与0.1mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲 | 乙 | 丙 | 丁 | |
0.1mol·L-1的Ba(OH)2 | 10 | 10 | 10 | 10 |
0.1mol·L-1的NaHSO4 | 5 | 10 | 15 | 20 |
按甲方式混合后,所得溶液的pH为____________;
按乙方式混合后,其反应的离子方程式:_________________。
按丁方式混合后,所得溶液显____________(填“酸”“碱”或“中”)性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铵铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程。
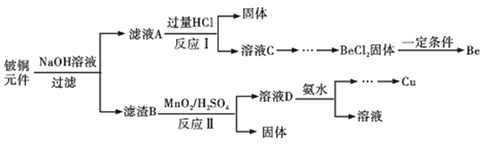
已知:
Ⅰ.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下:Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=2.1×10-13
(1)滤渣B的主要成分为______(填化学式);
(2)写出反应Ⅰ中含铍化合物与过量盐酸反应的化学方程式______;
(3)MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的离子方程式______,若用浓HNO3溶解金属硫化物缺点是______(任写一条);
(4)从BeCl2溶液中得到BeCl2固体的操作是______。
(5)溶液D中含c(Cu2+)=2.2molL-1、c(Fe3+)=0.008molL-1、c(Mn2+)=0.01molL-1,逐滴加入稀氨水调节pH可依次分离首先沉淀的是______(填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH大于______;
(6)取铍铜元件1000g,最终获得Be的质量为72g,则Be的产率是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知(Ⅰ)、(Ⅱ)反应在一定条件下焓变及平衡常数如下:
2H2(g)+S2(g)2H2S(g) ΔH1 K1 (Ⅰ)
3H2(g)+SO2(g)2H2O(g)+H2S(g) ΔH2 K2 (Ⅱ)
(1)用ΔH1、ΔH2表示反应4H2(g)+2SO2(g)=S2(g)+4H2O(g)的ΔH=________。
(2)回答下列反应(Ⅰ)的相关问题:
①温度为T1,在1 L恒容容器中加入1.8 mol H2、1.2 mol S2,10 min时反应达到平衡。测得10 min内v(H2S)=0.08 mol·L-1·min-1,则该条件下的平衡常数为________。
②温度为T2时(T2>T1),在1 L恒容容器中也加入1.8 mol H2、1.2 mol S2,建立平衡时测得S2的转化率为25%,据此判断ΔH1________0(填“>”或“<”),与T1时相比,平衡常数K1__(填“增大”“减小”或“不变”)。
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是________________(写出主要反应的离子方程式),该溶液中,c(Na+)______2c(SO32-)+c(HSO3-)(填“>”“<”或“=”)。
②在某NaHSO3、Na2SO3混合溶液中HSO3-、SO32-物质的量分数随pH变化曲线如图所示(部分),根据图示,则SO32-的水解平衡常数=________。
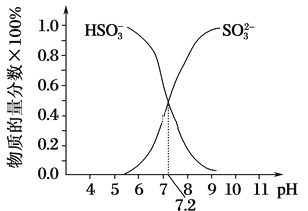
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示 3 套实验装置,分别回答下列问题。

(1)装置 1 为铁的吸氧腐蚀实验。向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶 液变红,该电极反应式为_____。
(2)装置 2 中左池为氯化铁溶液,右池为硫酸铜溶液,一段时间后右池溶液中 c(Cu2+)_____(填“增大”、“减小”或“不变”),若该装置的盐桥中盛装的是 NH4NO3 的琼脂溶液,则盐桥中的_____离子(填“NH4+ ”或“NO3-”)向氯化铁溶液迁移。
(3)装置 3 中甲烧杯盛放 100mL 0.2mol/L 的 NaCl 溶液,乙烧杯盛放 100mL 0.5mol/L 的 CuSO4 溶 液。反应一段时间后,观察到乙烧杯的石墨电极上有气泡生成。
①电源的 M 端为电源_____极。
②乙烧杯中电解反应的离子方程式为_____。
③停止电解,取出 Cu 电极,洗涤、干燥、称量,电极增重 0.32g,甲烧杯中产生的气体标准状况下体积为_________mL。
④若要将乙池设计成电解精炼铜的装置,则乙池的石墨应改成____(填“粗铜”或“精铜”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com