
【题目】实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是( )
A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
【答案】C
【解析】
A. 酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次,滴定时造成V(标准)偏大,根据c(待测)=![]() 可知c(待测)偏高,不符合题意,故A错误;
可知c(待测)偏高,不符合题意,故A错误;
B. 酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=![]() 可知c(待测)偏高,不符合题意,故B错误;
可知c(待测)偏高,不符合题意,故B错误;
C. 滴定过程中,锥形瓶内溶液颜色由黄色变为橙色,立即记下滴定管内液面所在刻度,造成V(标准)偏小,根据c(待测)=![]() 可知c(待测)偏低,符合题意,故C正确;
可知c(待测)偏低,符合题意,故C正确;
D. 盛NaOH溶液的锥形瓶滴定用NaOH溶液润洗,滴定时造成V(标准)偏大,根据c(待测)=![]() 可知c(待测)偏高,不符合题意,故D错误;
可知c(待测)偏高,不符合题意,故D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】Ⅰ.如图是中学化学中常用于混合物的分离和提纯的装置,请据此回答:
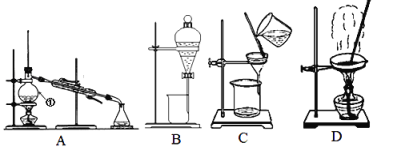
(1)除去自来水中的Cl-等杂质,选择装置____(填字母,下同);从氯化钠与单质碘的混合溶液中提取碘,选择装置_______,该分离方法的名称为____________。
(2)碳酸钙中混有氯化钠晶体,选择装置_____去除 。
(3)从NaCl(大量)和KNO3(少量)的混合溶液中分离出NaCl(晶体)的方法是____、___洗涤、干燥。
Ⅱ.甲同学设计如下实验方案,以分离KCl和BaCl2的固体混合物,试回答下列问题:
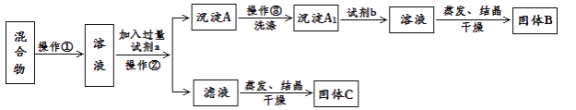
供选择的试剂有:盐酸、硫酸钾溶液、碳酸钾溶液、碳酸钠溶液
(1)操作①的名称是________,操作②的名称是________。
(2)试剂a是________,试剂b是________,固体B化学式________。
(3)加入试剂a所发生的化学反应方程式为:___________。
加入试剂b所发生的化学反应方程式为:____________。
(4)乙同学认为该方案不能达到实验目的,理由是:__________,改进方案为:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于密闭容器中的可逆反应:N2(g)+3H2(g)![]() 2NH3(g),400℃,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示.下列叙述正确的是
2NH3(g),400℃,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示.下列叙述正确的是
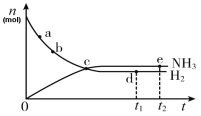
A. a点的正反应速率比b点的大B. c点处反应达到平衡
C. d点和e点处n(N2)不相等D. d点3v正(H2)= v逆(N2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氯化氢转化为氯气的技术成为科学研究的热点,在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如图所示。下列说法正确的是( )
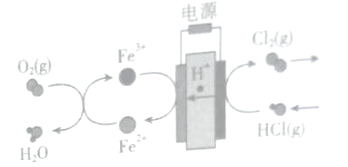
A.正极发生的电极反应为Fe3++e-=Fe2+
B.阳极反应为:2C1--2e-=Cl2↑
C.若消耗5.6L氧气,则电路中转移1mol电子
D.Fe3+在反应中起催化剂作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】误服铊盐会导致人体急性中毒,普鲁士蓝[KFe2(CN)6]可用作铊盐的解毒剂。
(1)Fe3+的价电子轨道表示式为___,与N同周期的主族元素中,第一电离能比N大的元素有___种。
(2)普鲁士蓝与硫酸作用可形成HCN,HCN的中心原子的杂化轨道类型为___,分子的立体构型是___,分子中σ键与π键数目之比为___。
(3)普鲁士蓝中的化学键不含有___(填字母)。
a.离子键
b.共价键
C.配位键
d.金属键
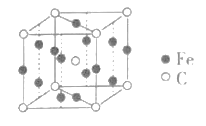
(4)已知FexCy的晶胞结构如图所示,则其化学式为___,铁原子的配位数是___。
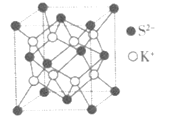
(5)如图为K2S的晶胞,该晶胞与CaF2晶胞结构相似,设晶体密度是ρg·cm-3,试计算K+与S2-的最短距离为___nm(阿伏加德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列加点的物质在化学反应中能完全消耗的是( )
A.向150mL3mol·L-1的稀硝酸中加入6.4g铜
B.标准状况下,将1g铁片投入15mL18.4mol·L-1的硫酸中
C.用50mL8mol·L-1浓盐酸与10g二氧化锰共热制取氯气
D.5×107Pa、500℃和铁触媒条件下,用1mol氮气和4mol氢气合成氨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一密闭容器中发生可逆反应:2E(g)![]() F(g)+xG(g) △H<0若起始时E的浓度为amol·L-1,F、G的浓度均为0,达到平衡时E的浓度为0.5amol·L-1。若起始时E的浓度为2amol·L-1,F、G的浓度均为0,达到平衡时,下列说法正确的是
F(g)+xG(g) △H<0若起始时E的浓度为amol·L-1,F、G的浓度均为0,达到平衡时E的浓度为0.5amol·L-1。若起始时E的浓度为2amol·L-1,F、G的浓度均为0,达到平衡时,下列说法正确的是
A. 升高温度时,正反应速率加快,逆反应速率减慢
B. 若x=1,容器的容积保持不变,则新平衡下E的体积分数为50%
C. 若x=2,容器的容积保持不变,则新平衡下F的平衡浓度大于0.5amol·L-1
D. 若x=2,容器内的压强保持不变,则新平衡下E的物质的量为amol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是2SO3(g) 2SO2(g) + O2(g) 的能量变化图,据图得出的相关叙述正确的是
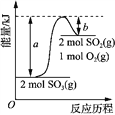
A. 2SO3(g) 2SO2(g) + O2(g) + (a-b) kJ
B. 1mol SO2的能量比1mol SO3的能量高
C. 若有2mol SO3充分反应,吸收(a-b) kJ热量
D. 该化学反应过程中的能量变化既有吸热又有放热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭体系中,可逆反应:A(s)+2B(g)![]() 2C(g) ΔH<0,不能作为该反应达到化学平衡的标志的是
2C(g) ΔH<0,不能作为该反应达到化学平衡的标志的是
①v正(B)=v逆(C) ②n(B)∶n(C)=1∶1 ③容器内压强不再改变
④容器内气体的密度不再改变 ⑤容器内混合气体的平均相对分子质量不再改变
A. ②③④⑤ B. ①③④ C. ②③ D. 全部
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com