
【题目】在给定条件下,下列加点的物质在化学反应中能完全消耗的是( )
A.向150mL3mol·L-1的稀硝酸中加入6.4g铜
B.标准状况下,将1g铁片投入15mL18.4mol·L-1的硫酸中
C.用50mL8mol·L-1浓盐酸与10g二氧化锰共热制取氯气
D.5×107Pa、500℃和铁触媒条件下,用1mol氮气和4mol氢气合成氨
【答案】A
【解析】
A.6.4g铜的物质的量n(Cu)=![]() ,稀硝酸的物质的量n(HNO3)=3mol/L×0.15L=0.45mol,铜和稀硝酸的反应方程式为3Cu+8HNO3(稀) =3Cu(NO3)2+2NO↑+4H2O,根据化学方程式可知;稀硝酸过量,铜消耗完,故A符合题意;
,稀硝酸的物质的量n(HNO3)=3mol/L×0.15L=0.45mol,铜和稀硝酸的反应方程式为3Cu+8HNO3(稀) =3Cu(NO3)2+2NO↑+4H2O,根据化学方程式可知;稀硝酸过量,铜消耗完,故A符合题意;
B.铁与浓硫酸在标况下会发生钝化,铁表面生成致密的氧化膜,阻止反应的进一步进行,故B不符合题意;
C.浓盐酸浓度变稀到一定浓度不会和二氧化锰发生氧化还原反应,则浓盐酸不能完全消耗,故C不符合题意;
D.合成氨在催化剂作用下反应是可逆反应,达平衡后反应物和产物都存在,氮气、氢气不能完全消耗,故D不符合题意;
答案选A。


科目:高中化学 来源: 题型:
【题目】25℃、101kPa时,能量转化如图,下列说法正确的是
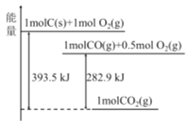
A.热化学方程式2CO(g)+O2(g)=2CO2(g)+282.9kJ
B.CO2是由极性键构成的极性分子
C.1molC(s)与1molCO2(g)生成2molCO(g)反应为放热反应
D.相同条件下,1molC(s)和0.5molO2(g)总能量高于1molCO(g)的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应①X(g)+2Y(g)![]() 2Z(g)、②2M(g)
2Z(g)、②2M(g)![]() N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
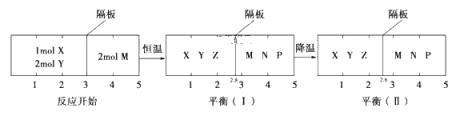
下列判断正确的是( )
A. 反应①的正反应是吸热反应
B. 达平衡(Ⅰ)时,X的转化率为5/6
C. 在平衡(Ⅰ)和平衡(Ⅱ)中,M的体积分数相等
D. 对于反应②,平衡(Ⅰ)时体系的压强与反应开始时体系的压强之比为10:11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,A、B、C三种气体在2L密闭容器中进行反应,在不同反应时间各物质的物质的量的变化情况如图所示。
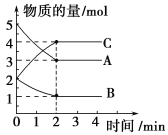
(1)该反应的化学方程式为___________________。
(2)反应开始至2 min时,用C表示的反应速率 = _____________。
(3)B的转化率= __________________。
(4)下列可判断反应已达到平衡状态的是___________。
a.A、B、C的反应速率相等 b.A、B的反应速率之比为2∶1
c.混合气体的压强不变 d.生成1 mol C的同时消耗1 mol A和0.5 mol B
e.混合气体的密度不变 f.混合气体的平均相对分子质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是( )
A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奥运五环代表着全世界五大洲的人民团结在一起。下列各项中的物质,能满足如图中阴影部分关系的是( )

① | ② | ③ | ④ | |
A | NaCl | K2SO4 | KCl | (NH4)2SO4 |
B | Na2SO4 | K2SO4 | KCl | NH4Cl |
C | NaCl | K2SO4 | KCl | NH4Cl |
D | Na2SO4 | K2SO4 | KCl | (NH4)2SO4 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明溶液中可能存在大量Ag+、Mg2+、Fe3+、Cu2+中的一种或几种,请填写下列空白。
(1)不用做任何实验就可以肯定溶液中不存在的离子是________________。
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,沉淀不消失,说明原溶液中肯定存在的离子是_______,有关反应的离子方程式为___________。
(3)取(2)的滤液加过量的NaOH溶液,出现白色沉淀,说明原溶液中肯定有________,有关反应的离子方程式为_________________________。
(4)原溶液中可能大量存在的阴离子是________(填序号)。
A.Cl- B.NO3- C. CO32- D.OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室里,用足量的浓盐酸与一定量的MnO2反应,来制取氯气。
⑴用“双线桥法”标出电子转移情况
MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
⑵若生成2.24L标准状况时的氯气,请计算(写出必要的计算过程):
①理论上需要多少克MnO2参加反应?
②被氧化的HCl的物质的量为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1L的恒容密闭容器中,用三种纳米级Cu2O分别进行催化分解水的实验:2H2O(g)![]() 2H2(g)+O2(g) ΔH>0。水蒸气的浓度c随时间t的变化如下表所示:
2H2(g)+O2(g) ΔH>0。水蒸气的浓度c随时间t的变化如下表所示:
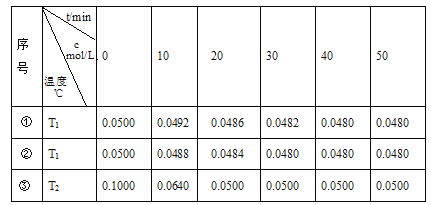
(1)对比实验的温度:T2_________T1(填“>”、“<”或“=”)
(2)催化剂催化效率:实验①________实验②(填“>”或“<”)
(3)在实验③达到平衡状态后,向该容器中通入水蒸气与氢气各0.1mol,则反应再次达到平衡时,请确定化学反应进行的方向_________________(填“向正反应反应进行”或“向逆反应方向进行”或“平衡不移动”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com