
【题目】可逆反应①X(g)+2Y(g)![]() 2Z(g)、②2M(g)
2Z(g)、②2M(g)![]() N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
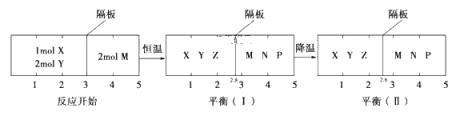
下列判断正确的是( )
A. 反应①的正反应是吸热反应
B. 达平衡(Ⅰ)时,X的转化率为5/6
C. 在平衡(Ⅰ)和平衡(Ⅱ)中,M的体积分数相等
D. 对于反应②,平衡(Ⅰ)时体系的压强与反应开始时体系的压强之比为10:11
科目:高中化学 来源: 题型:
【题目】NaCl是一种化工原料,可以制备一系列物质,如图所示。
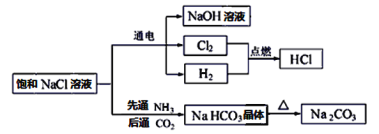
请回答下列问题:
(1)上述流程框图中属于电解质且存在熔融态导电的是________,属于非电解质的是_______。
(2)H2和Cl2的反应属于______________________(填字母。
A.化合反应 b.离子反应 c.氧化还原反应
(3)电解饱和NaCl溶液的化学方程式为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。该反应中氧化产物是___________,每转移0.2mol电子,共产生标准状况下气体的总体积是_____L。
2NaOH+H2↑+Cl2↑。该反应中氧化产物是___________,每转移0.2mol电子,共产生标准状况下气体的总体积是_____L。
(4)Na2CO3溶液中通入少量HCl,发生反应的离子方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业上常用氯化铁溶液做印刷电路铜板的腐蚀液,使用过的腐蚀废液中的金属离子主要有Fe3+、Fe2+和Cu2+。化学兴趣小组设计如下流程对废液进行处理并回收氯化铁溶液。
![]()
(1)步骤(Ⅰ)中加入H2O2溶液的目的是将Fe2+___(填“氧化”或“还原”)成Fe3+;取少量溶液A于试管中,滴入1~2滴KSCN溶液,溶液显___(填“红色”或“蓝色”)。
(2)步骤(Ⅱ)中分离溶液B和沉淀的操作名称是___;该操作需用到的玻璃仪器有烧杯、普通漏斗和___。
(3)写出步骤(Ⅲ)中Fe(OH)3与稀盐酸反应的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】秋冬季节是流感发作的高峰期,“84消毒液”能有效杀灭流感病毒。三台中学某同学购买的“84消毒液”瓶体部分标签如图所示,通常稀释100倍(体积比)后使用。请回答下列问题:
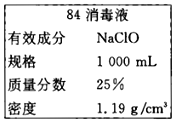
(1)该“84消毒液”的物质的量浓度约为______mol/L。
(2)该同学参阅“84消毒液”的配方,欲用NaClO固体配制240 mL浓度为0.4mol/L的消毒液:
①需要用托盘天平称量NaClO固体的质量为____________g。
②实验中所用的玻璃仪器除烧杯、玻璃棒、量筒外,还有_____________________。
(3)实验过程中下列操作或说法不正确的是_______________。
A、容量瓶用蒸馏水洗净之后,应烘干后才能用于溶液的配制
B、配制过程中,未用蒸馏水洗涤烧杯和玻璃棒会导致所得溶液浓度偏低
C、定容时,俯视刻度线会导致所得溶液浓度偏低
D、摇匀后,发现液面低于刻度线,又滴加蒸馏水至与刻度线相切
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于密闭容器中的可逆反应:N2(g)+3H2(g)![]() 2NH3(g),400℃,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示.下列叙述正确的是
2NH3(g),400℃,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示.下列叙述正确的是
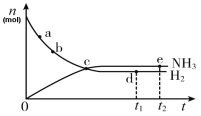
A. a点的正反应速率比b点的大B. c点处反应达到平衡
C. d点和e点处n(N2)不相等D. d点3v正(H2)= v逆(N2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生:N2+3H2![]() 2NH3。下列有关说法正确的是
2NH3。下列有关说法正确的是
A.达到化学反应最大限度时,正反应和逆反应的速率都为零
B.当符合:3正N2=正H2时,反应达到最大限度
C.达到化学最大限度时,单位时间消耗a mol N2,同时生成3a mol H2
D.当N2、H2、NH3的分子数比为1∶3∶2,反应达到最大限度态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氯化氢转化为氯气的技术成为科学研究的热点,在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如图所示。下列说法正确的是( )
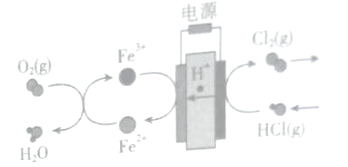
A.正极发生的电极反应为Fe3++e-=Fe2+
B.阳极反应为:2C1--2e-=Cl2↑
C.若消耗5.6L氧气,则电路中转移1mol电子
D.Fe3+在反应中起催化剂作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列加点的物质在化学反应中能完全消耗的是( )
A.向150mL3mol·L-1的稀硝酸中加入6.4g铜
B.标准状况下,将1g铁片投入15mL18.4mol·L-1的硫酸中
C.用50mL8mol·L-1浓盐酸与10g二氧化锰共热制取氯气
D.5×107Pa、500℃和铁触媒条件下,用1mol氮气和4mol氢气合成氨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据事实,书写下列热化学方程式:
(1)在25℃、101kPa时,1mol C与1mol水蒸气反应生成1mol CO和1mol H2,吸热131.5kJ:______________________。此反应的反应类型_________。
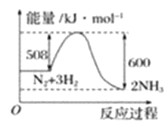
(2)根据如图写出热化学方程式____;此反应为____反应(放热或吸热);此反应的活化能____千焦。
(3)已知稀溶液中,1mol H2SO4与NaOH溶液恰好完全反应时,放出114.6kJ热量,写出表示H2SO4与NaOH反应中和热的热化学方程式________________________。
(4)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6kJ·mol–1
2SO3(g) ΔH=-196.6kJ·mol–1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0kJ·mol–1
2NO2(g) ΔH=-113.0kJ·mol–1
请写出NO2与SO2反应生成SO3和NO的热化学方程式_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com