
【题目】NaCl是一种化工原料,可以制备一系列物质,如图所示。
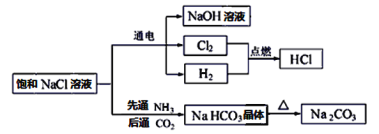
请回答下列问题:
(1)上述流程框图中属于电解质且存在熔融态导电的是________,属于非电解质的是_______。
(2)H2和Cl2的反应属于______________________(填字母。
A.化合反应 b.离子反应 c.氧化还原反应
(3)电解饱和NaCl溶液的化学方程式为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。该反应中氧化产物是___________,每转移0.2mol电子,共产生标准状况下气体的总体积是_____L。
2NaOH+H2↑+Cl2↑。该反应中氧化产物是___________,每转移0.2mol电子,共产生标准状况下气体的总体积是_____L。
(4)Na2CO3溶液中通入少量HCl,发生反应的离子方程式为_______________________。
【答案】Na2CO3 NH3、CO2 ac Cl2 4.48 CO32-+H+=HCO3-
【解析】
(1)电解质是在水溶液中或在熔融状态下就能够导电(自身电离成阳离子与阴离子)的化合物,非电解质是在水溶液中和在熔融状态下都不导电的化合物;
(2)化合反应特点为多变一,有化合价变化的为氧化还原反应;
(3)根据氧化还原反应的规律,还原剂对应的产物为氧化产物;对于![]() 。每生成2mol气体,转移电子数为2mol,据此来计算;
。每生成2mol气体,转移电子数为2mol,据此来计算;
(4)Na2CO3溶液中通入少量HCl,生成碳酸氢钠和氯化钠。
(1)饱和NaCl溶液、NaOH溶液属于混合物,Cl2、H2属于单质,HCl属于电解质但熔融状态不发生电离不导电,NH3、CO2属于非电解质,NaHCO3晶体属于电解质但受热易分解无熔融态,Na2CO3属于电解质熔融态能导电,故答案为:Na2CO3;NH3、CO2;
(2)反应![]() 属于化合反应,氧化还原反应,故答案为ac;
属于化合反应,氧化还原反应,故答案为ac;
(3)对于![]() Cl-失去电子发生氧化反应生成氧化产物Cl2。每生成2mol气体,转移电子数为2mol,则每转移0.2mol电子,共产生标准状况下气体的总体积是V=nVm=4.48L;故答案为Cl2;4.48;
Cl-失去电子发生氧化反应生成氧化产物Cl2。每生成2mol气体,转移电子数为2mol,则每转移0.2mol电子,共产生标准状况下气体的总体积是V=nVm=4.48L;故答案为Cl2;4.48;
(4)Na2CO3溶液中通入少量HCl,生成碳酸氢钠和氯化钠CO32-+H+=HCO3-,故答案为:CO32-+H+=HCO3-。


科目:高中化学 来源: 题型:
【题目】根据如图的转化关系判断下列说法正确的是(反应条件已略去)( )

A.反应①②③④⑤均属于氧化还原反应,反应③还属于置换反应
B.反应⑤说明该条件下铝可用于制熔点较高的金属
C.相同条件下生成等量的O2,反应③和④转移的电子数之比为1∶1
D.反应①中氧化剂与还原剂的物质的量之比为1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图,其中T原子的M层电子数比K层多2个,下列叙述不正确的是( )
![]()
A. 氢化物的稳定性:R<Q<T
B. T的单质是一种良好的半导体材料
C. Q、R的简单氢化物分子所含质子数、电子数与氖原子相同
D. T、W的最高价氧化物的水化物的酸性W强于T
查看答案和解析>>
科目:高中化学 来源: 题型:
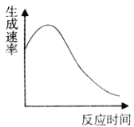
【题目】某实验小组探究H2O2分解的速率及影响因素,在相同温度下按照下表所示的方案完成实验。

(1)上述实验方案中,探究的变量因素只有催化剂的实验组合是_____和_____。
(2)实验④过程中氧气的生成速率和时间的趋势关系如图所示,判断该反应是反应(填“放热”或“吸热”)______。
(3)实验⑤:在试管中加入10mL 0.4mol/L H2O2溶液,加入固体催化剂,在一定温度下测得不同时刻生成O2的体积(以折算为标准状况)如下表所示(假设反应过程溶液的体积保持不变):
![]()
①反应6min,H2O2分解了_______%。
②0至6min,以H2O2的浓度变化表示的反应速率为υ(H2O2)=________molL-1min-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1)f在周期表中的位置是____________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):________>________;比较g、h的最高价氧化物对应水化物的酸性强弱:____________>____________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式:________________________。
(4)写出e的单质在空气中燃烧所得产物的电子式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1mol·L-1NaOH溶液滴定20mL0.1mol·L-1H2SO3溶液,所得滴定曲线如图所示(忽略混合时溶液体积的变化)。下列叙述不正确的是( )
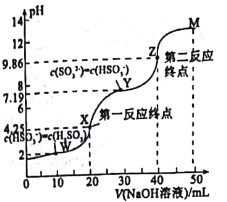
A.Ka2(H2SO3)的数量级为10-8
B.向X点加入少量澄清石灰水溶液,![]() 的值增大
的值增大
C.若将n(NaHSO3)与n(Na2SO3)=1:1混合,对应的点应在Y、Z之间
D.图中溶液中水的电离程度:W<X<Y<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
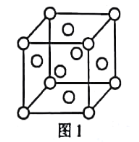
【题目】已知元素周期表中前四周期的元素a、b、C、d、e、f的原子序数依次增大。a、c的基态原子中均有2个未成对电子,c与d位于同一主族,元素e的基态原子的3d轨道上有2个电子,基态f原子M层有2个未成对电子且位于第Ⅷ族。
(1)元素e在周期表中的位置为___;f的单质的晶胞结构如图1所示,该晶胞为___堆积。
(2)c元素可分别与a、b元素组成多种简单阴离子,其中中心原子采用sp2杂化,空间构型为平面三角形的离子有___(填离子符号)。一个氢原子与一个a原子、一个b原子组成的分子中σ键和π键的数目之比为___。
(3)基态原子未成对电子数与b相同的前四周期元素中,除了与b同主族的元素外,还有___(填元素符号)。
(4)分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),d元素的低价酸性氧化物其大π键应表示___。
),d元素的低价酸性氧化物其大π键应表示___。
(5)c、f元素形成的一种晶体的晶胞结构如图2所示,其单原子层堆积结构实际如图3所示。
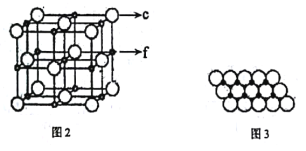
该①晶体的化学式是___。
②如图3中,c离子之间最短核间距为apm,NA表示阿伏加德罗常数的值。则该晶体中1m2单原子层的质量为___(用含a和NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101kPa时,能量转化如图,下列说法正确的是
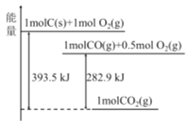
A.热化学方程式2CO(g)+O2(g)=2CO2(g)+282.9kJ
B.CO2是由极性键构成的极性分子
C.1molC(s)与1molCO2(g)生成2molCO(g)反应为放热反应
D.相同条件下,1molC(s)和0.5molO2(g)总能量高于1molCO(g)的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应①X(g)+2Y(g)![]() 2Z(g)、②2M(g)
2Z(g)、②2M(g)![]() N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
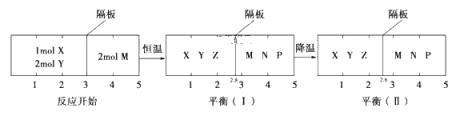
下列判断正确的是( )
A. 反应①的正反应是吸热反应
B. 达平衡(Ⅰ)时,X的转化率为5/6
C. 在平衡(Ⅰ)和平衡(Ⅱ)中,M的体积分数相等
D. 对于反应②,平衡(Ⅰ)时体系的压强与反应开始时体系的压强之比为10:11
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com