
����Ŀ��ijʵ��С��̽��H2O2�ֽ�����ʼ�Ӱ�����أ�����ͬ�¶��°����±���ʾ�ķ������ʵ�顣

��1������ʵ�鷽���У�̽���ı�������ֻ�д�����ʵ�������_____��_____��
��2��ʵ��ܹ������������������ʺ�ʱ������ƹ�ϵ��ͼ��ʾ���жϸ÷�Ӧ�Ƿ�Ӧ������������������������______��
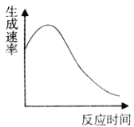
��3��ʵ��ݣ����Թ��м���10mL 0.4mol/L H2O2��Һ����������������һ���¶��²�ò�ͬʱ������O2�������������Ϊ��״�������±���ʾ�����跴Ӧ������Һ��������ֲ��䣩��
![]()
�ٷ�Ӧ6min��H2O2�ֽ���_______%��
��0��6min����H2O2��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ��(H2O2)=________molL-1min-1��
���𰸡��� �� ���� 50 0.03
��������
��1��̽���ı�������ֻ�д�����ʵ�������Ҫѡ�д�����ʵ�飬��ܷ������⣬ͬʱΪ�˱�֤����Ψһ����Ҫѡ�������գ��ʺ�����ʵ�����Ǣۢܣ�
��2���տ�ʼʱ����Ӧ���������ӣ�����Ϊ��Ӧ���ȣ��¶����ӿ췴Ӧ���ʣ�������Ӧ������С������ΪH2O2��Ũ�ȼ�������ģ��ʿ����жϳ��÷�Ӧ�Ƿ��ȷ�Ӧ��
��3���ٷ�Ӧ6min�ڣ�����O2 22.4mL����0.001mol������ݷ�Ӧ �ɼ�����ѷֽ��H2O2Ϊ0.002mol����H2O2�ķֽ���Ϊ
�ɼ�����ѷֽ��H2O2Ϊ0.002mol����H2O2�ķֽ���Ϊ![]() =50%��
=50%��
����(H2O2)=![]() =
=![]() =0.03molL-1min-1��
=0.03molL-1min-1��


 ��ĩ100�ִ��غ�������ϵ�д�
��ĩ100�ִ��غ�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ���������ʵ���Ũ�ȹ�ϵ��ȷ���ǣ� ��
A.0.1mol/L��NaHC2O4��Һ�д��ڣ�c(Na+) + c(H+)=c(HC2O4) + c(C2O42-) +c(OH)
B.0.1 mol/L��NaHX��ҺpHΪ4������Һ�У�c(HX)��c(H2X)��c(X2)��c(H+)��c(OH)
C.25��ʱ��pH=8��CH3COONa��Һ�У�c(CH3COOH)ԼΪ106 mol/L
D.��0.1mol/L�� NaF��Һ�У�c(HF)��c(F)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ڸ��������µ�ͬ���칹����Ŀ��ȷ����(����)
A. C4H10����������ͬ���칹����3��
B. ���������C5H10O2���������ͬ���칹����5��
C. ���������C4H8O����ȩ��ͬ���칹����3��
D. �ṹ��ʽΪ![]() ��һ�������5��
��һ�������5��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�ʾ��ѧ��ӦA(g)+2B(g)=3C(g)+D(g)�ڲ�ͬ�����µķ�Ӧ���ʣ�������
A.��(A)=0.3molL-1s-1B.��(B)=0.5molL-1s-1
C.��(C)=0.4molL-1s-1D.��(D)=0.6molL-1s-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����п��ع���ʾ��ͼ���£�ԭ��ΪZn+Ag2O+H2O=Zn(OH)2+2Ag������˵���������
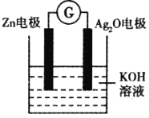
A.Zn�缫�Ǹ���
B.Ag2O�缫������ԭ��Ӧ
C.��װ�ÿ�ʵ�ֵ���ת��Ϊ��ѧ��
D.������Zn�缫����������Ag2O�缫
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ײ���MFe2Ox(3��x��4)��M��ʾ+2�۵Ľ���Ԫ�أ��ڷ�Ӧ�л��ϼ۲������仯�������£�MFe2Ox��ʹ��ҵ�����е�SO2ת��ΪS���������£��������ж���ȷ����( )
![]()
A.MFe2Ox��������
B.SO2�Ǹ÷�Ӧ�Ĵ���
C.x<y
D.MFe2Oy�ǻ�ԭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaCl��һ�ֻ���ԭ�ϣ������Ʊ�һϵ�����ʣ���ͼ��ʾ��
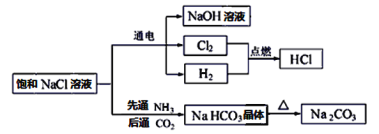
��ش��������⣺
��1���������̿�ͼ�����ڵ�����Ҵ�������̬�������________�����ڷǵ���ʵ���_______��
��2��H2��Cl2�ķ�Ӧ����______________________������ĸ��
A.���Ϸ�Ӧ b.���ӷ�Ӧ c.������ԭ��Ӧ
��3����ⱥ��NaCl��Һ�Ļ�ѧ����ʽΪ��2NaCl+2H2O![]() 2NaOH+H2��+Cl2�����÷�Ӧ������������___________��ÿת��0.2mol���ӣ���������״����������������_____L��
2NaOH+H2��+Cl2�����÷�Ӧ������������___________��ÿת��0.2mol���ӣ���������״����������������_____L��
��4��Na2CO3��Һ��ͨ������HCl��������Ӧ�����ӷ���ʽΪ_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʮ���ͳ��¹���ѧ�ҹ�������ʦ��ʩ�ɹ��ؿ����˺ϳɰ����������գ�Ϊ���ķ�չ�ͽ����������ش��ס�����ѧ��Ϊ��߰��IJ������Լ��Ը��ְ��Ļ�������о������Ÿ��������̽�����Իش��������⣺
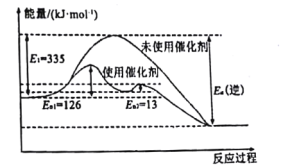
��1��N2��g��+3H2��g��![]() 2NH3��g�� ��H =-92.4kJ��mol-1��ͼ��ʾ���ϳɰ���Ӧ��δʹ�ô���ʱ���淴Ӧ�Ļ��Ea���棩=___kJ��mol-1��
2NH3��g�� ��H =-92.4kJ��mol-1��ͼ��ʾ���ϳɰ���Ӧ��δʹ�ô���ʱ���淴Ӧ�Ļ��Ea���棩=___kJ��mol-1��
��2������һ�������£��ֱ�lmolN2��3molH2�����ݻ��㶨���ܱ������У��ﻯѧƽ��״̬ʱ��NH3���������Ϊ10%�������������������䣬��ʼʱ��Ϊ����2molN2��2molH2������ƽ���NH3���������Ϊ___10%������>������<������=������
��ij�¶��£�n��N2����n��H2��=1��3�Ļ�������ڸ��������ڷ�����Ӧ����ʼʱ������ѹΪp0Pa��ƽ��ʱ������ѹΪ0.9p0Pa�������ѹ��p����=������ѹ��p�����������������ij���ʵ�ƽ���ѹ�������ʵ���Ũ��Ҳ���Ա�ʾ��ѧ��Ӧƽ�ⳣ��������Kp��������¶��£��÷�Ӧ�Ļ�ѧƽ�ⳣ��Kp=___���ú�p0�Ĵ���ʽ��ʾ����
��3���ϳɰ���Ҫ��H2��Դ�ȽϹ㷺�������Ĵ����Ʊ�������Ҳ����õ�������ں��º��ݵ��ܱ������У�ij���ⷴӦ��MHx��s��+yH2��g��![]() MHx+2y��s����H<0�ﵽ��ѧƽ�⡣�����й�������ȷ������______��
MHx+2y��s����H<0�ﵽ��ѧƽ�⡣�����й�������ȷ������______��
a.����������ѹǿ���ֲ���
b.����ymolH2��1molMHx
c.����������ͨ��������������ƽ���c��H2����ԭƽ���
d.����������ͨ��������������v�����⣩>v�����⣩
��4�������ִ��ֳּ�������������̽��ѹǿ�Ի�ѧƽ���ƶ���Ӱ�죬����2NO2��g��![]() N2O4��g��Ϊ�����ں㶨�¶Ⱥͱ�ѹǿ��100kPa�������£�����Ͳ�г���һ�������NO2������ܷⲢ���ֻ���λ�ò��䡣�ֱ���t1��t2ʱ��Ѹ���ƶ��������ֻ���λ�ò��䣨�������¶ȵı仯�����ⶨ��Ͳ������ѹǿ�仯��ͼ��ʾ��
N2O4��g��Ϊ�����ں㶨�¶Ⱥͱ�ѹǿ��100kPa�������£�����Ͳ�г���һ�������NO2������ܷⲢ���ֻ���λ�ò��䡣�ֱ���t1��t2ʱ��Ѹ���ƶ��������ֻ���λ�ò��䣨�������¶ȵı仯�����ⶨ��Ͳ������ѹǿ�仯��ͼ��ʾ��
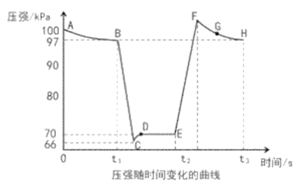
��B��E�����Ӧ������Ӧ���ʴ�СΪvB___vE������>������<������=������
��E��F��G��H�ĵ�ʱ��Ӧ�����ƽ����Է����������ĵ�Ϊ___��
��5��NH3�ܹ���Ag+�γ�Ag(NH3)2+����Һ�д���Ag+(aq)+2NH3(aq)![]() Ag(NH3)2+(aq)�����£�K[Ag(NH3)2+]=1.10��107����ӦAgCl(s)+2NH3(aq)
Ag(NH3)2+(aq)�����£�K[Ag(NH3)2+]=1.10��107����ӦAgCl(s)+2NH3(aq)![]() Ag(NH3)2(aq)++Cl-(aq)�Ļ�ѧƽ�ⳣ��K=1.936��10-3����Ksp��AgCl��=___��
Ag(NH3)2(aq)++Cl-(aq)�Ļ�ѧƽ�ⳣ��K=1.936��10-3����Ksp��AgCl��=___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ﶬ���������з����ĸ߷��ڣ���84����Һ������Чɱ�����в�������̨��ѧijͬѧ�������84����Һ��ƿ�岿�ֱ�ǩ��ͼ��ʾ��ͨ��ϡ��100��������ȣ���ʹ�á���ش��������⣺
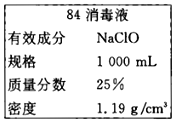
��1������84����Һ�������ʵ���Ũ��ԼΪ______mol/L��
��2����ͬѧ������84����Һ�����䷽������NaClO��������240 mLŨ��Ϊ0.4mol/L������Һ��
����Ҫ��������ƽ����NaClO���������Ϊ____________g��
��ʵ�������õIJ����������ձ�������������Ͳ�⣬����_____________________��
��3��ʵ����������в�����˵������ȷ����_______________��
A������ƿ������ˮϴ��֮��Ӧ��ɺ����������Һ������
B�����ƹ����У�δ������ˮϴ���ձ��Ͳ������ᵼ��������ҺŨ��ƫ��
C������ʱ�����ӿ̶��ᵼ��������ҺŨ��ƫ��
D��ҡ�Ⱥ���Һ����ڿ̶��ߣ��ֵμ�����ˮ����̶�������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com