
【题目】已知元素周期表中前四周期的元素a、b、C、d、e、f的原子序数依次增大。a、c的基态原子中均有2个未成对电子,c与d位于同一主族,元素e的基态原子的3d轨道上有2个电子,基态f原子M层有2个未成对电子且位于第Ⅷ族。
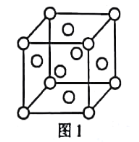
(1)元素e在周期表中的位置为___;f的单质的晶胞结构如图1所示,该晶胞为___堆积。
(2)c元素可分别与a、b元素组成多种简单阴离子,其中中心原子采用sp2杂化,空间构型为平面三角形的离子有___(填离子符号)。一个氢原子与一个a原子、一个b原子组成的分子中σ键和π键的数目之比为___。
(3)基态原子未成对电子数与b相同的前四周期元素中,除了与b同主族的元素外,还有___(填元素符号)。
(4)分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),d元素的低价酸性氧化物其大π键应表示___。
),d元素的低价酸性氧化物其大π键应表示___。
(5)c、f元素形成的一种晶体的晶胞结构如图2所示,其单原子层堆积结构实际如图3所示。
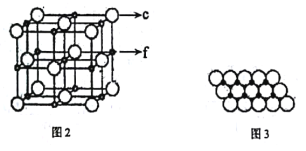
该①晶体的化学式是___。
②如图3中,c离子之间最短核间距为apm,NA表示阿伏加德罗常数的值。则该晶体中1m2单原子层的质量为___(用含a和NA的代数式表示)。
【答案】第四周期第ⅣB族 面心立方最密 NO3-、CO32- 1:1 V、Co ![]() NiO
NiO ![]() g
g
【解析】
元素e的基态原子的3d轨道上有2个电子,其基态原子的核外电子排布应为1s22s22p63s23p63d24s2,为Ti元素;基态f原子M层有2个未成对电子且位于第Ⅷ族,其基态原子的核外电子排布应为1s22s22p63s23p63d84s2,为Ni元素;c与d位于同一主族,其原子序数小于Ti,则a、b、c、d均为前20元素,且a、b、c为短周期元素,a、c的基态原子中均有2个未成对电子,则其p轨道的电子排布为np2或np4,为第ⅣA族或ⅥA族元素,又因为c、d同主族,且d为前20号元素,所以c只能为第二周期元素,则a、c的p轨道电子排布为2p2和2p4,即a为C,c为O,则d为S,b位于a、c之间,则b为N。
(1)e为Ti元素,为22号元素,位于元素周期表第四周期第ⅣB族;f为Ni元素,据图可知该晶胞堆积为面心立方最密堆积;
(2)a为C,b为N,c为O,其中中心原子采用sp2杂化,空间构型为平面三角形的离子有NO3-、CO32-;一个氢原子与一个a原子、一个b原子组成的分子为HCN,中心C原子为sp杂化,与N原子形成三键,其中有1个σ键和2个π键,与H原子形成1个σ键,所以分子中σ键和π键的数目之比为1:1;
(3)b为N,其未成对电子为3对,前四周期基态原子未成对电子数与其相同的元素的外围电子排布应为3s23p3或3d34s2或3d84s2,分别为P、V、Co,其中P与N元素同主族;
(4)d为S,其低价酸性氧化物为SO2,在SO2分子中,硫原子以两个sp2杂化轨道分别与两个氧原子形成σ键,而另一个sp2杂化轨道上则保留1对孤对电子,硫原子的未参与杂化的p轨道上的2个电子与两个氧原子的未成对p电子形成三中心、四电子的离域大π键,表示为![]() ;
;
(5)①c为O,f为Ni,根据均摊法可知该晶胞中O原子个数为![]() =4,Ni原子个数为
=4,Ni原子个数为![]() =4,所以晶体的化学式为NiO;
=4,所以晶体的化学式为NiO;
②取平面NiO基本结构单元为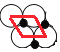 ,重复单元呈菱形, O离子之间最短核间距为a pm,则结构单元的面积为:(a×a×sin60°)m2=
,重复单元呈菱形, O离子之间最短核间距为a pm,则结构单元的面积为:(a×a×sin60°)m2=![]() a2×10-24m2,每个重复单元包含1个O原子和1个Ni原子,其质量=
a2×10-24m2,每个重复单元包含1个O原子和1个Ni原子,其质量=![]() g,则1m2上该晶体的质量=
g,则1m2上该晶体的质量= =
=![]() g。
g。


科目:高中化学 来源: 题型:
【题目】硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)下列物质不属于硅酸盐的是______。
A.陶瓷 B.玻璃 C.水泥 D.生石灰
(2)SiO2是玻璃的主要成分之一,SiO2与氢氧化钠溶液反应的化学方程式为_____,工艺师常用_____(填物质名称)来雕刻玻璃。
(3)用Na2SiO3水溶液浸泡过的棉花不易燃烧,说明Na2SiO3可用作______。Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是_____。
A.普通玻璃坩埚 B.石英玻璃坩埚 C.氧化铝坩埚 D.铁坩埚
(4)工业上常利用反应2C+SiO2![]() Si+2CO↑制备硅单质,该反应中所含元素化合价升高的物质是_____(填化学式,下同),氧化剂是_____。
Si+2CO↑制备硅单质,该反应中所含元素化合价升高的物质是_____(填化学式,下同),氧化剂是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银锌电池工作示意图如下,原理为Zn+Ag2O+H2O=Zn(OH)2+2Ag,下列说法错误的是
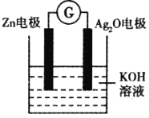
A.Zn电极是负极
B.Ag2O电极发生还原反应
C.该装置可实现电能转化为化学能
D.电子由Zn电极经导线流向Ag2O电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl是一种化工原料,可以制备一系列物质,如图所示。
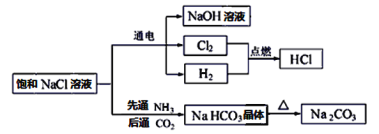
请回答下列问题:
(1)上述流程框图中属于电解质且存在熔融态导电的是________,属于非电解质的是_______。
(2)H2和Cl2的反应属于______________________(填字母。
A.化合反应 b.离子反应 c.氧化还原反应
(3)电解饱和NaCl溶液的化学方程式为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。该反应中氧化产物是___________,每转移0.2mol电子,共产生标准状况下气体的总体积是_____L。
2NaOH+H2↑+Cl2↑。该反应中氧化产物是___________,每转移0.2mol电子,共产生标准状况下气体的总体积是_____L。
(4)Na2CO3溶液中通入少量HCl,发生反应的离子方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的学科。回答下列问题:
(1)认识仪器是正确使用仪器的前提。

写出上述仪器的名称:A___________;B__________;C_________。
(2)实验室利用胆矾晶体和烧碱制备氧化铜固体时,其实验操作如下:
Ⅰ.混合 Ⅱ.过滤 Ⅲ.加热分解 Ⅳ.溶解 Ⅴ.洗涤
就此实验完成下列填空:
①正确的操作步骤是______________(填罗马数字)。
②操作Ⅱ中用到的玻璃仪器除烧杯、玻璃棒外,还需要用到上述仪器中的________(填字母)。
③在实验中多次用到玻璃棒,其作用有三个,分别是______、_______和转移。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二十世纪初德国化学家哈伯和工程师博施成功地开发了合成氨的生产工艺,为社会的发展和进步做出了重大贡献。如今科学家为提高氨的产量,以及对各种氨的化合物的研究仍做着各种有益的探索。试回答下列问题:
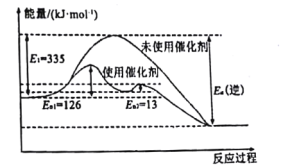
(1)N2(g)+3H2(g)![]() 2NH3(g) △H =-92.4kJ·mol-1如图所示,合成氨反应中未使用催化剂时,逆反应的活化能Ea(逆)=___kJ·mol-1。
2NH3(g) △H =-92.4kJ·mol-1如图所示,合成氨反应中未使用催化剂时,逆反应的活化能Ea(逆)=___kJ·mol-1。
(2)①在一定条件下,分别将lmolN2和3molH2置于容积恒定的密闭容器中,达化学平衡状态时,NH3的体积分数为10%,若保持其他条件不变,起始时改为充入2molN2和2molH2,达新平衡后,NH3的体积分数为___10%(填“>”、“<”或“=”)。
②某温度下,n(N2):n(H2)=1:3的混合气体在刚性容器内发生反应,起始时气体总压为p0Pa,平衡时气体总压为0.9p0Pa,气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学反应平衡常数(记作Kp),则此温度下,该反应的化学平衡常数Kp=___(用含p0的代数式表示)。
(3)合成氨需要的H2来源比较广泛,氢气的储存制备等问题也日益得到解决。在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)![]() MHx+2y(s)△H<0达到化学平衡。下列有关叙述正确的是(______)
MHx+2y(s)△H<0达到化学平衡。下列有关叙述正确的是(______)
a.容器内气体压强保持不变
b.吸收ymolH2需1molMHx
c.若向容器内通入少量氢气,新平衡后c(H2)比原平衡大
d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)利用现代手持技术传感器可以探究压强对化学平衡移动的影响,如以2NO2(g)![]() N2O4(g)为例。在恒定温度和标准压强(100kPa)条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞后并保持活塞位置不变(不考虑温度的变化)。测定针筒内气体压强变化如图所示:
N2O4(g)为例。在恒定温度和标准压强(100kPa)条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞后并保持活塞位置不变(不考虑温度的变化)。测定针筒内气体压强变化如图所示:
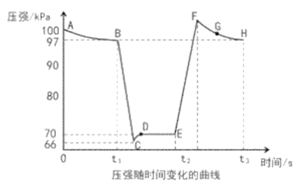
①B、E两点对应的正反应速率大小为vB___vE(填“>”、“<”或“=”)。
②E、F、G、H四点时对应气体的平均相对分子质量最大的点为___。
(5)NH3能够和Ag+形成Ag(NH3)2+,溶液中存在Ag+(aq)+2NH3(aq)![]() Ag(NH3)2+(aq)常温下,K[Ag(NH3)2+]=1.10×107,反应AgCl(s)+2NH3(aq)
Ag(NH3)2+(aq)常温下,K[Ag(NH3)2+]=1.10×107,反应AgCl(s)+2NH3(aq)![]() Ag(NH3)2(aq)++Cl-(aq)的化学平衡常数K=1.936×10-3,则Ksp(AgCl)=___。
Ag(NH3)2(aq)++Cl-(aq)的化学平衡常数K=1.936×10-3,则Ksp(AgCl)=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图是中学化学中常用于混合物的分离和提纯的装置,请据此回答:
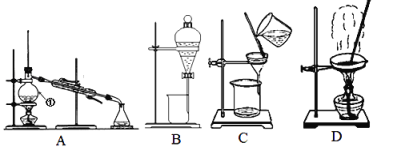
(1)除去自来水中的Cl-等杂质,选择装置____(填字母,下同);从氯化钠与单质碘的混合溶液中提取碘,选择装置_______,该分离方法的名称为____________。
(2)碳酸钙中混有氯化钠晶体,选择装置_____去除 。
(3)从NaCl(大量)和KNO3(少量)的混合溶液中分离出NaCl(晶体)的方法是____、___洗涤、干燥。
Ⅱ.甲同学设计如下实验方案,以分离KCl和BaCl2的固体混合物,试回答下列问题:
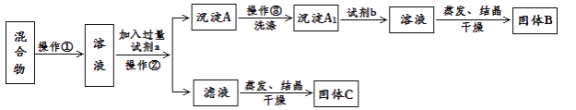
供选择的试剂有:盐酸、硫酸钾溶液、碳酸钾溶液、碳酸钠溶液
(1)操作①的名称是________,操作②的名称是________。
(2)试剂a是________,试剂b是________,固体B化学式________。
(3)加入试剂a所发生的化学反应方程式为:___________。
加入试剂b所发生的化学反应方程式为:____________。
(4)乙同学认为该方案不能达到实验目的,理由是:__________,改进方案为:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业上常用氯化铁溶液做印刷电路铜板的腐蚀液,使用过的腐蚀废液中的金属离子主要有Fe3+、Fe2+和Cu2+。化学兴趣小组设计如下流程对废液进行处理并回收氯化铁溶液。
![]()
(1)步骤(Ⅰ)中加入H2O2溶液的目的是将Fe2+___(填“氧化”或“还原”)成Fe3+;取少量溶液A于试管中,滴入1~2滴KSCN溶液,溶液显___(填“红色”或“蓝色”)。
(2)步骤(Ⅱ)中分离溶液B和沉淀的操作名称是___;该操作需用到的玻璃仪器有烧杯、普通漏斗和___。
(3)写出步骤(Ⅲ)中Fe(OH)3与稀盐酸反应的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氯化氢转化为氯气的技术成为科学研究的热点,在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如图所示。下列说法正确的是( )
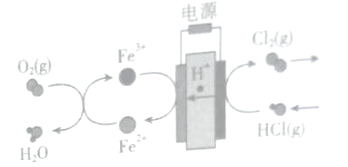
A.正极发生的电极反应为Fe3++e-=Fe2+
B.阳极反应为:2C1--2e-=Cl2↑
C.若消耗5.6L氧气,则电路中转移1mol电子
D.Fe3+在反应中起催化剂作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com