
【题目】Ⅰ.如图是中学化学中常用于混合物的分离和提纯的装置,请据此回答:
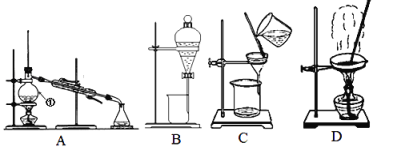
(1)除去自来水中的Cl-等杂质,选择装置____(填字母,下同);从氯化钠与单质碘的混合溶液中提取碘,选择装置_______,该分离方法的名称为____________。
(2)碳酸钙中混有氯化钠晶体,选择装置_____去除 。
(3)从NaCl(大量)和KNO3(少量)的混合溶液中分离出NaCl(晶体)的方法是____、___洗涤、干燥。
Ⅱ.甲同学设计如下实验方案,以分离KCl和BaCl2的固体混合物,试回答下列问题:
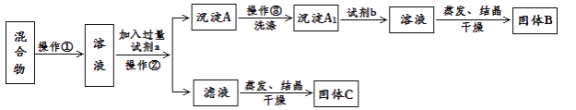
供选择的试剂有:盐酸、硫酸钾溶液、碳酸钾溶液、碳酸钠溶液
(1)操作①的名称是________,操作②的名称是________。
(2)试剂a是________,试剂b是________,固体B化学式________。
(3)加入试剂a所发生的化学反应方程式为:___________。
加入试剂b所发生的化学反应方程式为:____________。
(4)乙同学认为该方案不能达到实验目的,理由是:__________,改进方案为:______________。
【答案】A B 萃取 C 蒸发结晶 趁热过滤 溶解 过滤 K2CO3 HCl BaCl2 K2CO3+BaCl2═BaCO3↓+2KCl BaCO3+2HCl=BaCl2+H2O+CO2↑ 滤液中有过量的CO32-未除去 蒸发前,加入稀盐酸将碳酸钾转化为氯化钾
【解析】
Ⅰ.(1)除去自来水中的Cl-等杂质,可以利用沸点不同分离;碘不易溶于水,易溶于有机溶剂,据此分析解答;
(2)碳酸钙不溶于水,而氯化钠易溶于水;
(3)NaCl和KNO3的溶解度随温度变化不同,可用重结晶的方法分离;
Ⅱ.分离KCl和BaCl2两种固体混合物,先将两种物质溶于水,然后加入过量K2CO3使BaCl2转化为沉淀,则试剂a为K2CO3,过滤后在沉淀中加入盐酸可生成BaCl2溶液,则试剂b为盐酸,经蒸发、结晶、干燥后可得固体BaCl2,操作②所得滤液为KCl和K2CO3的混合物,应加入过量盐酸可得KCl,以此分析解答。
Ⅰ.(1)除去自来水中的Cl-等杂质,可以采用蒸馏的方法,则选择A装置;从氯化钠与碘水的混合溶液中分离出I2,可以加入四氯化碳进行萃取,选择B装置,故答案为A;B;萃取;
(2)碳酸钙中混有氯化钠晶体,碳酸钙难溶于水,而氯化钠易溶于水,可以通过溶解过滤的方法除去碳酸钙中的氯化钠,选择装置C,故答案为C;
(3)NaCl和KNO3的溶解度随温度变化不同,可用重结晶的方法分离,由于含有少量硝酸钾,应使硝酸钾残留在母液中,可用蒸发结晶的方法,趁热过滤分离出氯化钠,故答案为蒸发结晶、趁热过滤;
Ⅱ(1)将固体配成溶液,应加水溶解,操作②为固体和液体的分离,为过滤操作,故答案为溶解;过滤;
(2)固体溶解后加入过量K2CO3使BaCl2转化为沉淀,过滤后沉淀中加入盐酸可生成BaCl2溶液,经蒸发、结晶、干燥后可得固体BaCl2,故答案为K2CO3;HCl;BaCl2;
(3)加入试剂a,K2CO3与BaCl2反应生成BaCO3沉淀,发生的化学方程式为K2CO3+BaCl2═BaCO3↓+2KCl,加入试剂b,BaCO3沉淀加入盐酸可生成BaCl2溶液,反应的化学方程式为BaCO3+2HCl=BaCl2+H2O+CO2↑,故答案为K2CO3+BaCl2═BaCO3↓+2KCl;BaCO3+2HCl=BaCl2+H2O+CO2↑;
(4)滤液为KCl和K2CO3的混合物,蒸发结晶前应加入适量稀盐酸,将过量的碳酸钾转化成氯化钾,故答案为滤液中有过量的CO32-未除去;蒸发前,加入稀盐酸将碳酸钾转化为氯化钾。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】由SO2和O2制备SO3(熔点16.8℃,沸点44.8℃)的模拟装置如下图所示)(加热和夹持装置省略):

下列说法正确的是
A. 装置①中的试剂为饱和NaHSO3溶液
B. 实验室可用铜与稀硫酸在加热条件下制取SO2
C. 裝置③反应管中的铂石棉用作反应的催化剂
D. 从装置⑤逸出的气体有过量的SO2和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1)f在周期表中的位置是____________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):________>________;比较g、h的最高价氧化物对应水化物的酸性强弱:____________>____________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式:________________________。
(4)写出e的单质在空气中燃烧所得产物的电子式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素周期表中前四周期的元素a、b、C、d、e、f的原子序数依次增大。a、c的基态原子中均有2个未成对电子,c与d位于同一主族,元素e的基态原子的3d轨道上有2个电子,基态f原子M层有2个未成对电子且位于第Ⅷ族。
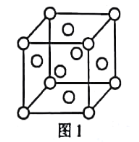
(1)元素e在周期表中的位置为___;f的单质的晶胞结构如图1所示,该晶胞为___堆积。
(2)c元素可分别与a、b元素组成多种简单阴离子,其中中心原子采用sp2杂化,空间构型为平面三角形的离子有___(填离子符号)。一个氢原子与一个a原子、一个b原子组成的分子中σ键和π键的数目之比为___。
(3)基态原子未成对电子数与b相同的前四周期元素中,除了与b同主族的元素外,还有___(填元素符号)。
(4)分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),d元素的低价酸性氧化物其大π键应表示___。
),d元素的低价酸性氧化物其大π键应表示___。
(5)c、f元素形成的一种晶体的晶胞结构如图2所示,其单原子层堆积结构实际如图3所示。
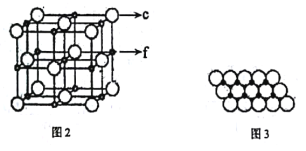
该①晶体的化学式是___。
②如图3中,c离子之间最短核间距为apm,NA表示阿伏加德罗常数的值。则该晶体中1m2单原子层的质量为___(用含a和NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以“物质的量”为中心的计算是化学计算的基础,下列与“物质的量”相关的计算正确的是( )
A.现有CO、CO2、O3三种气体,它们分别都含有1 mol O,则三种气体的物质的量之比为3∶2∶1
B.5.6 g CO和22.4 L CO2中含有的碳原子数一定相等
C.标准状况下,11.2 L X气体分子的质量为16 g,则X气体的摩尔质量是32
D.a g Cl2中有b个氯原子,则阿伏加德罗常数NA的数值可表示为35.5b/a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101kPa时,能量转化如图,下列说法正确的是
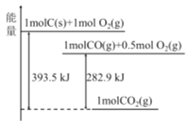
A.热化学方程式2CO(g)+O2(g)=2CO2(g)+282.9kJ
B.CO2是由极性键构成的极性分子
C.1molC(s)与1molCO2(g)生成2molCO(g)反应为放热反应
D.相同条件下,1molC(s)和0.5molO2(g)总能量高于1molCO(g)的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置可用于收集SO2并验证其某些化学性质,关于该实验的现象和结论描述有误的是
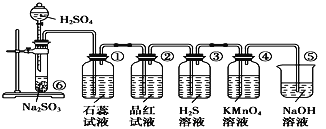
A.①中石蕊试液先变红后褪色,说明SO2溶于水呈酸性且有漂白性
B.②中品红溶液褪色,说明SO2有漂白性
C.③中硫化氢水溶液变浑浊,说明SO2有氧化性
D.④中酸性KMnO4溶液褪色,说明SO2有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某此气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置),用此装置和相关试剂不能制取的气体是( )
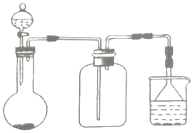
A.NH3B.SO2C.NO2D.Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是( )
A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com