
【题目】如图装置可用于收集SO2并验证其某些化学性质,关于该实验的现象和结论描述有误的是
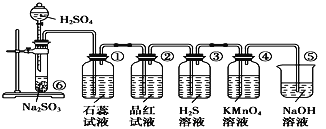
A.①中石蕊试液先变红后褪色,说明SO2溶于水呈酸性且有漂白性
B.②中品红溶液褪色,说明SO2有漂白性
C.③中硫化氢水溶液变浑浊,说明SO2有氧化性
D.④中酸性KMnO4溶液褪色,说明SO2有还原性
科目:高中化学 来源: 题型:
【题目】某调香剂的分子式为C12H14O2,该调香剂广泛用于制作香精。某实验室科研人员设计了下列合成路线合成该调香剂。
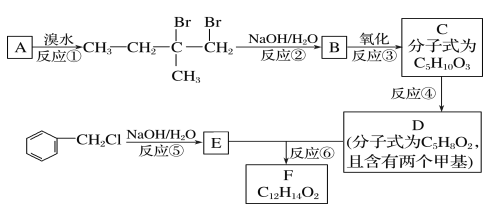
试回答下列问题:
(1)B物质的分子式为____,其分子中有____种不同类型的氢原子。
(2)D物质的官能团名称是____。
(3)上述合成路线中属于取代反应的是____(填编号)。
(4)写出反应③、⑥的化学方程式:
③______,
⑥______。
(5)F有多种同分异构体,符合下列条件的同分异构体共有___种,写出其中一种的结构简式:__。
①属于芳香族化合物,且含有与F相同的官能团;
②苯环上有两个取代基,且苯环上的一氯代物只有两种;
其中一个取代基为—CH2COOCH3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的学科。回答下列问题:
(1)认识仪器是正确使用仪器的前提。

写出上述仪器的名称:A___________;B__________;C_________。
(2)实验室利用胆矾晶体和烧碱制备氧化铜固体时,其实验操作如下:
Ⅰ.混合 Ⅱ.过滤 Ⅲ.加热分解 Ⅳ.溶解 Ⅴ.洗涤
就此实验完成下列填空:
①正确的操作步骤是______________(填罗马数字)。
②操作Ⅱ中用到的玻璃仪器除烧杯、玻璃棒外,还需要用到上述仪器中的________(填字母)。
③在实验中多次用到玻璃棒,其作用有三个,分别是______、_______和转移。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图是中学化学中常用于混合物的分离和提纯的装置,请据此回答:
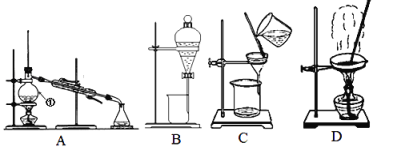
(1)除去自来水中的Cl-等杂质,选择装置____(填字母,下同);从氯化钠与单质碘的混合溶液中提取碘,选择装置_______,该分离方法的名称为____________。
(2)碳酸钙中混有氯化钠晶体,选择装置_____去除 。
(3)从NaCl(大量)和KNO3(少量)的混合溶液中分离出NaCl(晶体)的方法是____、___洗涤、干燥。
Ⅱ.甲同学设计如下实验方案,以分离KCl和BaCl2的固体混合物,试回答下列问题:
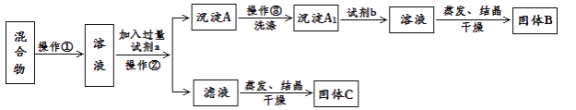
供选择的试剂有:盐酸、硫酸钾溶液、碳酸钾溶液、碳酸钠溶液
(1)操作①的名称是________,操作②的名称是________。
(2)试剂a是________,试剂b是________,固体B化学式________。
(3)加入试剂a所发生的化学反应方程式为:___________。
加入试剂b所发生的化学反应方程式为:____________。
(4)乙同学认为该方案不能达到实验目的,理由是:__________,改进方案为:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某一溴代烷与浓NaOH的醇溶液共热时产生3种沸点不同的消去产物,该一溴代烷至少应含有________个碳原子,其中一种结构简式可表示为____________。
Ⅱ.某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢。
(1)A的结构简式为________。
(2)A中的碳原子是否都处于同一平面?________(填“是”或者“不是”);
Ⅲ.有机物A分子式为C3H6O2,把它进行实验并记录现象如下:
NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 | 金属钠 | |
A | 发生水解反应 | 有银镜反应 | 有红色沉淀 | 不反应 |
A的结构简式为:_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业上常用氯化铁溶液做印刷电路铜板的腐蚀液,使用过的腐蚀废液中的金属离子主要有Fe3+、Fe2+和Cu2+。化学兴趣小组设计如下流程对废液进行处理并回收氯化铁溶液。
![]()
(1)步骤(Ⅰ)中加入H2O2溶液的目的是将Fe2+___(填“氧化”或“还原”)成Fe3+;取少量溶液A于试管中,滴入1~2滴KSCN溶液,溶液显___(填“红色”或“蓝色”)。
(2)步骤(Ⅱ)中分离溶液B和沉淀的操作名称是___;该操作需用到的玻璃仪器有烧杯、普通漏斗和___。
(3)写出步骤(Ⅲ)中Fe(OH)3与稀盐酸反应的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光刻胶(I)是半导体制造的一种重要材料,其中一种合成路线如下,完成下列填空。
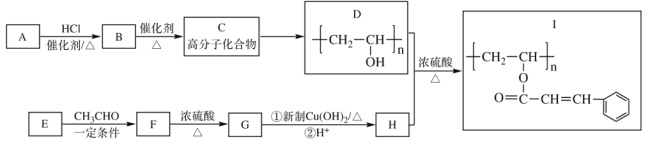
已知:![]()
(1)A的电子式_____________,E的结构简式_____________;
(2)C→D反应的试剂和条件为_____________,F→G的反应类型_____________;
(3)D+H→I的化学反应方程式___________________________________________;
(4)H的芳香类同分异构体中,可以发生水解反应和银镜反应的有_________种;
(5)![]() 是重要的工业加工助剂,写出以乙烯和乙醛为原料制备
是重要的工业加工助剂,写出以乙烯和乙醛为原料制备![]() 的合成路线。(其它无机试剂任选),(合成路线常用的表达方式为:A
的合成路线。(其它无机试剂任选),(合成路线常用的表达方式为:A B
B 目标产物)___________________
目标产物)___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于密闭容器中的可逆反应:N2(g)+3H2(g)![]() 2NH3(g),400℃,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示.下列叙述正确的是
2NH3(g),400℃,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示.下列叙述正确的是
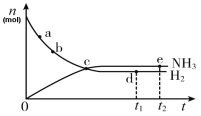
A. a点的正反应速率比b点的大B. c点处反应达到平衡
C. d点和e点处n(N2)不相等D. d点3v正(H2)= v逆(N2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一密闭容器中发生可逆反应:2E(g)![]() F(g)+xG(g) △H<0若起始时E的浓度为amol·L-1,F、G的浓度均为0,达到平衡时E的浓度为0.5amol·L-1。若起始时E的浓度为2amol·L-1,F、G的浓度均为0,达到平衡时,下列说法正确的是
F(g)+xG(g) △H<0若起始时E的浓度为amol·L-1,F、G的浓度均为0,达到平衡时E的浓度为0.5amol·L-1。若起始时E的浓度为2amol·L-1,F、G的浓度均为0,达到平衡时,下列说法正确的是
A. 升高温度时,正反应速率加快,逆反应速率减慢
B. 若x=1,容器的容积保持不变,则新平衡下E的体积分数为50%
C. 若x=2,容器的容积保持不变,则新平衡下F的平衡浓度大于0.5amol·L-1
D. 若x=2,容器内的压强保持不变,则新平衡下E的物质的量为amol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com