
【题目】某小组同学利用下图装置进行电化学实验,相关说法正确的是![]()
![]()
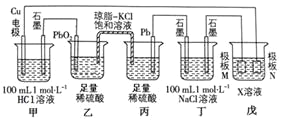
A.乙池中发生的电极反应式为:![]()
B.工作时,盐桥中的![]() 向丙池迁移,
向丙池迁移,![]() 向乙池迁移
向乙池迁移
C.当电路中通过![]() 电子时,甲、丁两池均产生
电子时,甲、丁两池均产生![]() 气体
气体
D.若戊池的目的是在铜材料上镀银,则极板N的材料应选择纯铜
【答案】C
【解析】
根据装置图,乙、丙为构成铅蓄电池,Pb为负极,PbO2为正极,甲、丁、戊为电解池,按照电解原理,甲中石墨为阳极,Cu电极为阴极,丁中左端石墨为阴极,右端石墨为阳极,戊中M为阴极,N为阳极,据此分析;
A. 乙、丙构成电池装置,PbO2为正极,Pb为负极,乙池中发生的电极反应式为:![]() ,故A错误;
,故A错误;
B. 乙是原电池的正极,丙是原电池的负极,根据原电池工作原理,阴离子移向原电池的负极,阳离子移向原电池的正极,即工作时,盐桥中的K+向乙池迁移,![]() 向丙池迁移,故B错误;
向丙池迁移,故B错误;
C. 甲和丁均为电解池,氯离子物质的量均是![]() ,则当电路中通过
,则当电路中通过![]() 电子时,
电子时,![]() 的量不足,会出现两段电解,阳极先产生氯气再生氧气,阴极产生氢气,最终得到氢气是
的量不足,会出现两段电解,阳极先产生氯气再生氧气,阴极产生氢气,最终得到氢气是![]() 、氯气
、氯气![]() 、氧气
、氧气![]() ,甲、丁两池均产生
,甲、丁两池均产生![]() 气体,故C正确;
气体,故C正确;
D. M板是阴极,N板是阳极,若戊池的目的是在铜材料上镀银,则极板N的材料应选择银,故D错误;
答案:C。


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】氢能源是最具应用前景的能源之一。
(1)氢氧燃料电池是一种高效无污染的清洁电池,用KOH溶液作电解质溶液,其负极反应式为_____________,理论上,正极消耗氧气2.8 L(标况下)时,电路中有__________mol e-通过。
(2)高纯氢的制备是目前的研究热点。可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制双控开关,可交替得到H2和O2。

①太阳能光伏电池是将光能转化为__________能。
②当连接K1时可制得____________气体。
③当连接K2时,电极2附近pH_________(填“变大”、“变小”或“不变”)。
④当连接K2时,电极3作______极,其电极反应式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物广泛分布于植物、昆虫及微生物体内,是多种香料和药物的主要成分,Ⅰ是一种萜类化合物,它的合成路线如图所示:

已知:
Ⅰ.
Ⅱ.
Ⅲ.
回答下列问题:
(1)A的名称是________,![]() 的反应类型是_________;
的反应类型是_________;
(2)流程中设计![]() 这步反应的作用________;
这步反应的作用________;
(3)![]() 第一步的化学反应方程式__________;
第一步的化学反应方程式__________;
(4)B含有一个环状结构,其结构简式为__________;它的同分异构体有多种,其中符合下列条件的有____________种(不考虑立体异构)
①不含有环状结构 ②能发生银镜反应 ③能与![]() 反应生成
反应生成![]()
(5)F与![]() 按物质的量
按物质的量![]() 发生反应生成G的化学方程式为_________;
发生反应生成G的化学方程式为_________;
(6)请以![]() 、
、![]() 为原料,结合题目所给信息,制备高分子化合物
为原料,结合题目所给信息,制备高分子化合物 的流程________。
的流程________。
例如:原料![]() ……目标化合物
……目标化合物

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2 与 H2 合成(CH3)2O(二甲醚)是煤化工中的重要反应,有关信息如下:2CO2(g)+6H2(g) ![]() (CH3)2O(g)+3H2O(g) ΔH<0 恒容下,该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是( ) (K 表示该反应的平衡常数)
(CH3)2O(g)+3H2O(g) ΔH<0 恒容下,该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是( ) (K 表示该反应的平衡常数)
A.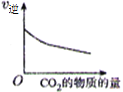 B.
B.
C.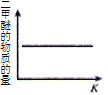 D.
D.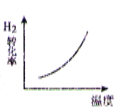
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1mL 1.0 mol·L-1盐酸溶液和V2mL未知浓度的氢氧化钠溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。
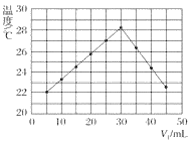
下列叙述正确的是( )
A.做该实验时环境温度为20 ℃
B.该实验表明化学能可能转化为热能
C.氢氧化钠溶液的浓度约为1.0 mol·L-1
D.该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是
A.甲的相对分子质量比乙的相对分子质量小B.甲的摩尔体积比乙的摩尔体积小
C.甲的分子数比乙的分子数少D.甲中所含的原子数比乙中的所含的原子数少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴趣小组探究锌片与盐酸、醋酸反应时,浓度或温度对反应速率的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、0.10mol/LCuCl2、锌片(形状、大小、质量相同)、秒表、碳棒、导线、烧杯、几支试管和胶头滴管,酸液温度控制为298K和308K。
酸液都取足量、相同体积,请你帮助完成下面实验设计表(表中不留空格):
实验编号 | 温度(K) | 盐酸浓度 | 醋酸浓度 | 实验目的 |
① | 298 | 0.20mol/L |
| a.实验①和②是探究_____对锌与盐酸反应速率的影响; b.实验①和③是探究_____对锌与盐酸反应速率的影响; c.实验①和④是探究相同温度下,相同 浓度的盐酸、醋酸与锌反应速率的区别 |
② | 308 | 0.20mol/L |
| |
③ | 298 | 0.40mol/L |
| |
④ | ______ |
| 0.20mol/L |
(2)若(1)中实验①锌片消失的时间是20s,则锌片剩余质量与时间关系图如下图:
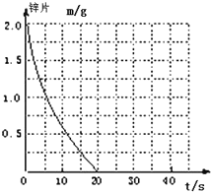
假设:该反应温度每升高10℃,反应速率是原来的2倍;温度相同、浓度相同时,醋酸的平均反应速度是盐酸的1/2.请你在此图中大致画出“实验②”(用实线)、“实验④中醋酸实验”(用虚线)的锌片质量与时间关系曲线.____________________________
(3)某实验小组在做(1)中实验④时误加少量0.10mol/LCuCl2溶液,发现反应速率与(1)中实验①接近,加少量0.10mol/LCuCl2溶液后速率变快的原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为摇摆电池![]() 的工作原理图,在充放电过程中,
的工作原理图,在充放电过程中,![]() 在两极之间“摇来摇去”,其总反应为:
在两极之间“摇来摇去”,其总反应为:![]() ,下列有关说法正确的是
,下列有关说法正确的是
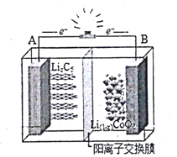
A.放电时,负极反应![]()
B.充电时,A极发生氧化反应
C.充电时,![]() 穿过隔离膜向B极移动
穿过隔离膜向B极移动
D.当B极失去xmol电子,电池消![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.3kJ/moL,N2的平衡转化率a(N2)与体系总压强(p)的关系如图所示。下列说法正确的是( )
2NH3(g) ΔH=-92.3kJ/moL,N2的平衡转化率a(N2)与体系总压强(p)的关系如图所示。下列说法正确的是( )
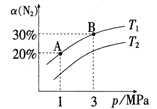
A.将1molN2与3molH2置于1L密闭容器中充分反应,放出的热量为92.3kJ
B.T1<T2
C.平衡状态由A变到B时,平衡常数K(A)<K(B)
D.升高温度,平衡向逆反应方向移动,逆反应速率增大,正反应速率减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com