
【题目】铝土矿的主要成分是Al2O3、SiO2和Fe2O3等。从铝土矿中提炼Al2O3的流程如下:
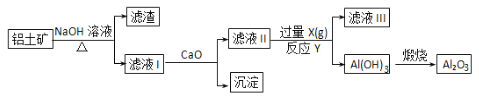
下列说法中错误的是 ( )
A. 滤液Ⅰ的主要成分是Na2SiO3、NaAlO2和NaOH
B. 滤液Ⅲ的含大量的阴离子是HCO3-
C. 反应Y的离子方程式是2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D. 滤液Ⅱ中通入过量的X的目的是使AlO2-充分沉淀而不引进杂质
【答案】C
【解析】
铝土矿中加入氢氧化钠溶液,氧化铝和二氧化硅与氢氧化钠反应生成偏铝酸钠和硅酸钠,则滤液Ⅰ为偏铝酸钠和硅酸钠,且含有过量的氢氧化钠,滤渣为氧化铁,在滤液Ⅰ中加入氧化钙,氧化钙和水反应生成氢氧化钙,进而生成硅酸钙沉淀,滤液Ⅱ为偏铝酸钠,可通入二氧化碳气体,生成氢氧化铝,煅烧可生成氧化铝。A.由以上分析可知滤液Ⅰ的主要成分为硅酸钠和偏铝酸钠和氢氧化钠,故正确;B.在偏铝酸钠溶液中通入过量的二氧化碳,生成氢氧化铝沉淀和碳酸氢钠,则滤液Ⅲ的含大量的阴离子是碳酸氢根离子,故正确;C.二氧化碳过量,生成碳酸氢钠,离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故错误;D.滤液Ⅱ溶液中含有偏铝酸钠和氢氧化钙,通入过量的二氧化碳,可生成碳酸氢钙,防止氢氧化铝中混有碳酸钙,故正确。故选C。


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】关于电解槽的叙述不正确的是( )
A. 是电能转变成化学能的装置B. 与电源正极相连的是阳极
C. 阴极失去电子,发生氧化反应D. 参与电解的阳离子移向阴极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,所采取的分离方法与对应原理都正确的是( )
选项 | 目的 | 分离方法 | 原理 |
A | 分离溶于水的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
B | 除去KNO3固体中混杂的NaCl | 降温结晶 | NaCl在水中的溶解度很大 |
C | 分离汽油和水 | 分液 | 汽油和水的密度不同 |
D | 由海水(含NaCl)获得蒸馏水 | 蒸馏 | 水的沸点与NaCl的沸点不司 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上常用AG表示溶液中的lg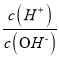 。25℃时,用0.100 molL-1的NaOH溶液滴定20.00 mL 0.100 molL-1的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法正确的是
。25℃时,用0.100 molL-1的NaOH溶液滴定20.00 mL 0.100 molL-1的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法正确的是
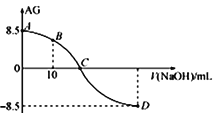
A. 滴定过程中,应选用甲基橙做指示剂
B. B点溶液中存在 c(H+)-c(OH-)=c(NO2-)-c(HNO2)
C. C点时,加入NaOH溶液的体积为20 mL
D. 25℃时,HNO2的电离常数Ka=1.0×10-4.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HA是一元弱酸
(1)常温下,下列事实能证明HA是弱电解质的是________。
①某NaA溶液的pH=9
②用HA溶液做导电实验,灯泡很暗
③等浓度、等体积的硫酸和HA溶液分别与足量锌反应,硫酸产生的氢气多
④0.1 mol·L-1 HA溶液的pH≈2.8
⑤配制相同浓度的硫酸和HA,分别测定两溶液的pH,硫酸的pH小于HA的pH
(2)某温度时,0.1 mol·L-1的HA溶液中的c(H+)与0.01 mol·L-1的HA溶液中的c(H+)的比值________(填“大于”“小于”或“等于”)10。
(3)已知:25 ℃时,HA的电离平衡常数为6.25×10-7。
①求该温度时,0.1 mol·L-1的HA溶液中c1(H+)=__________mol·L-1。[水电离出的c(H+)、c(OH-)忽略不计,下同]
②若该温度时向该溶液中加入一定量的NH4A(假设溶液体积不变),使溶液中c(A-)变为5×10-2 mol·L-1,则此时c2(H+)=________mol·L-1。
(4)已知:常温下,NH3·H2O的电离平衡常数为1.74×10-5;则 NH4A溶液呈________性,NH4A溶液中物质的量浓度最大的离子是________(填化学式)。
(5)现用某未知浓度(设为c′)的CH3COOH溶液及其他仪器、药品,通过实验测定一定温度下CH3COOH的电离平衡常数,需测定的数据有(用简要的文字说明):
①实验时的温度;②______________;③用_______(填一种实验方法)测定CH3COOH溶液浓度c′。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是
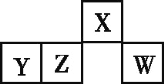
A. 原子半径:rW>rZ>rY>rX
B. 含Y元素的硫酸盐溶液可以和强酸、强 碱反应
C. 最简单气态氢化物的热稳定性: Z>W
D. X的氢化物与X的最高价氧化物对应的水化物能形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相同质量的下列各烃,完全燃烧后生成CO2最多的是____(填标号)
A.乙炔 B.乙烯 C.乙烷 D.甲烷
(2)某烃的一种同分异构体,核磁共振氢谱测得分子中只有一个吸收峰,则该烃的分子式可能为______(填标号)
A.C6H14 B.C7H16 C.C8H18 D.C9H20
(3)乙烯和丙烯属于同系物。下列叙述正确的是_____上(填标号)
A.等质量的乙烯和丙烯完全燃烧耗氧量相同
B.丙烯分子中三个碳原子处于同一直线上
C.乙烯和丙烯与HCl加成均有两种产物
D.以丙烯为单体加聚可以生成![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com