
【题目】下列过程只涉及物理变化的是( )
A.蜡炬成灰B.自然固氮C.海水晒盐D.百炼成钢
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组用如图所示装置进行实验,探究铁和浓硫酸反应的产物及性质。(夹持装置已略,气密性已检验)
实验开始前,先打开活塞K通一段时间N2。关闭活塞K后,向A中滴加一定量的浓硫酸,加热观察到A中铁片上有气泡产生。
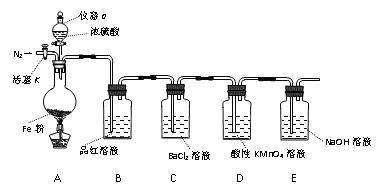
请回答下列问题:
(1)仪器a的名称是____。实验开始前,先通一段时间N2的目的是____。
(2)加热一段时间后发现B装置中溶液褪色,说明有____(填化学式)生成。再取出A中反应后的溶液少许,加入KSCN溶液未出现血红色,浓硫酸与铁反应的化学方程式是____。
(3)C装置中____(填“有”或“无”)沉淀生成。D中溶液紫色褪去,体现气体产物的____性(填“氧化”、“还原”或“漂白性”)。
(4)E装置的作用是____。(用离子方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学在日常生活中用途广泛,图①是镁-次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图②是Cr2O72-的工业废水的处理。下列说法正确的是( )

A. 图②中Cr2O72-离子向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
B. 图②的电解池中,有0.084g阳极材料参与反应,阴极会有336mL的气体产生(标况)
C. 图①中发生的还原反应是:Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓
D. 若图①中3.6g镁溶解产生的电量用以图②废水处理,理论可产生10.7g氢氧化铁沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.向Na2CO3溶液中逐滴加入HCl,直到不再生成CO2气体为止,在此过程中.溶液中的HCO3-浓度变化是先变大后变小(溶液体积变化均忽略不计)
B.向NaHCO3溶液中加入Ba(OH)2固体,CO32-的浓度变化是先变大后变小(溶液体积变化均忽略不计)
C.有含0.2molNa2CO3和含0.3molHCl的两种溶液:①将Na2CO3溶液逐滴滴入HCl溶液中;②将HCl溶液逐滴滴入Na2CO3溶液中,①②两种操作生成的CO2体积之比为3:2
D.将等质量的Na2O和Na2O2样品分别放入等量的水中,所得溶液的质量分数分别为a%和b%,则a、b的关系是a=b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,另含少量杂质FeCO3和SiO2等)为原料制备高纯氧化镁的实验流程如下:
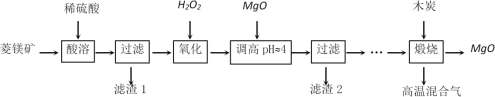
(1)酸溶时,MgCO3与稀硫酸反应的离子方程式为_____________________________。
(2)滤渣1的化学式为__________________。
(3)写出流程中“氧化”的离子方程式为______________________________________。
(4)调节pH时,使用pH试纸的具体操作是取一小块pH试纸放在洁净的玻璃片上,_______________________________________________________;滤渣2中除了过量的MgO外,还含有的物质是____________。
(5)高温煅烧过程中,同时存在以下反应:2MgSO4+C![]() 2MgO+2SO2↑+CO2↑;MgSO4+C
2MgO+2SO2↑+CO2↑;MgSO4+C![]() MgO+SO2↑+CO↑;MgSO4+3C高温MgO+S↑+3CO↑。利用下图装置对煅烧产生的气体进行连续分别吸收或收集(其中S蒸气在A管中沉积)。
MgO+SO2↑+CO↑;MgSO4+3C高温MgO+S↑+3CO↑。利用下图装置对煅烧产生的气体进行连续分别吸收或收集(其中S蒸气在A管中沉积)。
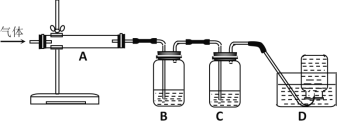
①D中收集的气体是_________________(填化学式)。
②B中盛放的溶液是__________________(填下列选项的字母编号)。
a.NaOH溶液 b.Na2CO3溶液 c.稀硝酸 d.酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大改变。
Ⅰ.(1)铁元素在周期表中的位置为___________。
(2)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是___________ (填字母)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
Ⅱ.下图是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、SiO2)为原料制备高纯氧化铁的生产流程示意图:

回答下列问题:
(1)酸浸、过滤后滤液A中的金属阳离子是 ___________ 。
(2)煅烧FeCO3生成产品Ⅰ的化学方程式为___________。
(3)已知几种盐的溶解度随温度变化的曲线如图所示,产品Ⅱ的化学式为 ___________ 。

(4)写出步骤Ⅳ反应的离子方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据有关媒体报道,美国华裔科学家叶军领导一个研究小组成功制造出全球最准确的时钟,两亿年误差不足一秒。它是一个锶原子钟,比铯原子喷泉钟准确得多,估计将可大大促进不同的电讯网络的发展,将使全球各地的船只导航变得更为准确。请根据锶、铯在元素周期表中的位置,推断下列内容:
(1)锶元素属于________(填“金属”或“非金属”)元素,金属性比钙元素________(填“强”或“弱”),锶原子的核内质子数为________,原子核外有________个电子层,其原子结构示意图为________,其原子半径________镁(填“大于”、“小于”或“等于”);铯的原子核外共有________层电子,最外层电子数为________。
(2)铯与水起剧烈反应,放出________色气体,同时使滴有紫色石蕊试液的溶液显________色,因为______________________(写出化学方程式)。
(3)碳酸锶是________色粉末,与盐酸反应的离子方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分是Al2O3、SiO2和Fe2O3等。从铝土矿中提炼Al2O3的流程如下:
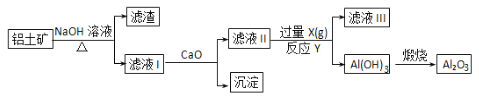
下列说法中错误的是 ( )
A. 滤液Ⅰ的主要成分是Na2SiO3、NaAlO2和NaOH
B. 滤液Ⅲ的含大量的阴离子是HCO3-
C. 反应Y的离子方程式是2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D. 滤液Ⅱ中通入过量的X的目的是使AlO2-充分沉淀而不引进杂质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com