
【题目】氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,另含少量杂质FeCO3和SiO2等)为原料制备高纯氧化镁的实验流程如下:
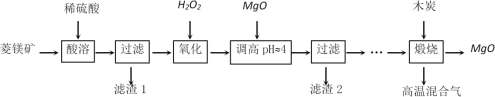
(1)酸溶时,MgCO3与稀硫酸反应的离子方程式为_____________________________。
(2)滤渣1的化学式为__________________。
(3)写出流程中“氧化”的离子方程式为______________________________________。
(4)调节pH时,使用pH试纸的具体操作是取一小块pH试纸放在洁净的玻璃片上,_______________________________________________________;滤渣2中除了过量的MgO外,还含有的物质是____________。
(5)高温煅烧过程中,同时存在以下反应:2MgSO4+C![]() 2MgO+2SO2↑+CO2↑;MgSO4+C
2MgO+2SO2↑+CO2↑;MgSO4+C![]() MgO+SO2↑+CO↑;MgSO4+3C高温MgO+S↑+3CO↑。利用下图装置对煅烧产生的气体进行连续分别吸收或收集(其中S蒸气在A管中沉积)。
MgO+SO2↑+CO↑;MgSO4+3C高温MgO+S↑+3CO↑。利用下图装置对煅烧产生的气体进行连续分别吸收或收集(其中S蒸气在A管中沉积)。
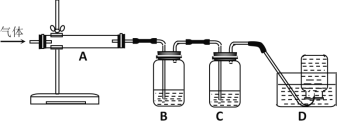
①D中收集的气体是_________________(填化学式)。
②B中盛放的溶液是__________________(填下列选项的字母编号)。
a.NaOH溶液 b.Na2CO3溶液 c.稀硝酸 d.酸性KMnO4溶液
【答案】MgCO3+2H+=Mg2++CO2↑+H2O SiO2 2Fe2++2H++H2O2=2Fe3++2H2O 用洁净干燥的玻璃棒蘸取待测溶液点在试纸的中部,再与比色卡对照得出读数 Fe(OH)3 CO d
【解析】
以菱镁矿(主要成分为MgCO3,另含少量杂质FeCO3和SiO2等)为原料,加入稀硫酸酸溶过滤得到滤液为硫酸镁、硫酸亚铁溶液,滤渣1为二氧化硅,滤液中加入过氧化氢,亚铁离子被氧化为铁离子,加入氧化镁调节溶液pH沉淀铁离子,过滤得到滤渣2为氢氧化铁沉淀,滤液为硫酸镁溶液,蒸发浓缩,冷却结晶,过滤洗涤得硫酸镁,硫酸镁和木炭高温煅烧制备高纯氧化镁,据此解答。
(1)MgCO3与稀硫酸反应生成硫酸镁、二氧化碳和水,反应的离子方程式为MgCO3+2H+=Mg2++CO2↑+H2O;
(2)二氧化硅不溶于稀硫酸,则滤渣1的化学式为SiO2;
(3)加入H2O2氧化时,在酸性溶液中氧化硫酸亚铁,反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O;
(4)调节pH时,使用pH试纸的具体操作是取一小块pH试纸放在洁净的玻璃片上,用洁净干燥的玻璃棒蘸取待测溶液点在试纸的中部,再与比色卡对照得出读数;调节pH时铁离子转化为氢氧化铁沉淀,则滤渣2中除了过量的MgO外,还含有的物质是Fe(OH)3;
(5)根据方程式可知煅烧得到的气体主要有SO2、CO2、CO、S,产生的气体进行分步吸收或收集,所以通过A使硫蒸气冷凝下来,再通过B装置高锰酸钾溶液吸收二氧化硫,通过C中的氢氧化钠溶液吸收二氧化碳,最后剩余一氧化碳气体在D中收集;
①CO难溶于水,D中收集的气体可以是CO;
②装置B吸收二氧化硫,由于二氧化碳、二氧化硫均与氢氧化钠溶液、碳酸钠溶液反应,稀硝酸能把二氧化硫氧化,但同时生成NO气体,所以B中盛放的溶液选择KMnO4溶液吸收二氧化硫,故答案为d。


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 含有不同种元素的纯净物叫做化合物
B. 水溶液中能电离出H+的化合物一定是酸
C. 盐中一定含有金属元素
D. 非金属氧化物一定是酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,11.2 L CH3CH2OH中含有的分子数目为0.5NA
B.14g分子式为CnH2n的链烃中含有的C-H键的数目为2NA
C.室温时,1.0 L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA
D.Fe与水蒸气反应生成22.4L氢气,转移电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是________(填序号)。
①铝和盐酸、NaOH溶液的反应中,铝作还原剂
②等质量的铝与足量的盐酸、NaOH溶液反应放出的H2物质的量相等
③等体积等物质的量浓度的盐酸、NaOH溶液与过量的Al反应,产生H2的物质的量相等
④铝与NaOH溶液反应中,每转移3 mol e-,就生成1.5 mol H2
⑤化学方程式中各物质的化学计量数之比等于各物质的质量之比
⑥根据方程式2Na+2H2O===2NaOH+H2↑,可知2 mol Na与足量水反应放出22.4 L氢气
⑦根据离子方程式Mg+2H+===Mg2++H2↑,可知1 g Mg与足量H+反应生成1 mol氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上常用AG表示溶液中的lg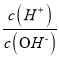 。25℃时,用0.100 molL-1的NaOH溶液滴定20.00 mL 0.100 molL-1的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法正确的是
。25℃时,用0.100 molL-1的NaOH溶液滴定20.00 mL 0.100 molL-1的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法正确的是
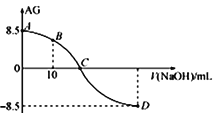
A. 滴定过程中,应选用甲基橙做指示剂
B. B点溶液中存在 c(H+)-c(OH-)=c(NO2-)-c(HNO2)
C. C点时,加入NaOH溶液的体积为20 mL
D. 25℃时,HNO2的电离常数Ka=1.0×10-4.5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com