
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,11.2 L CH3CH2OH中含有的分子数目为0.5NA
B.14g分子式为CnH2n的链烃中含有的C-H键的数目为2NA
C.室温时,1.0 L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA
D.Fe与水蒸气反应生成22.4L氢气,转移电子数为2NA
科目:高中化学 来源: 题型:
【题目】25℃时,向Na2CO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。

已知:lgX=lg![]() 或lg
或lg![]() ,下列叙述正确的是
,下列叙述正确的是
A. 曲线m表示pH与lg![]() 的变化关系
的变化关系
B. 当溶液呈中性时,c(Na+)=![]() +2
+2![]()
C. Ka1(H2CO3)=1.0×10-6.4
D. 25℃时,CO32-+H2O![]()
![]() +OH-的平衡常数为1.0×10-7.6
+OH-的平衡常数为1.0×10-7.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀溶液中含有4 mol KNO3和2.5 mol H2SO4,向其中加入1.5 mol Fe,充分反应(已知NO3-被还原为NO),最终溶液体积为1L。下列说法正确的是
A. 所得溶液中c(NO3-)=2.75 mol·L-1
B. 所得溶液中c(Fe2+):c(Fe3+)=1:2
C. 反应后生成NO的体积为33.6 L(标准状况下)
D. 所得溶液中的溶质只有FeSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学在日常生活中用途广泛,图①是镁-次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图②是Cr2O72-的工业废水的处理。下列说法正确的是( )

A. 图②中Cr2O72-离子向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
B. 图②的电解池中,有0.084g阳极材料参与反应,阴极会有336mL的气体产生(标况)
C. 图①中发生的还原反应是:Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓
D. 若图①中3.6g镁溶解产生的电量用以图②废水处理,理论可产生10.7g氢氧化铁沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.向Na2CO3溶液中逐滴加入HCl,直到不再生成CO2气体为止,在此过程中.溶液中的HCO3-浓度变化是先变大后变小(溶液体积变化均忽略不计)
B.向NaHCO3溶液中加入Ba(OH)2固体,CO32-的浓度变化是先变大后变小(溶液体积变化均忽略不计)
C.有含0.2molNa2CO3和含0.3molHCl的两种溶液:①将Na2CO3溶液逐滴滴入HCl溶液中;②将HCl溶液逐滴滴入Na2CO3溶液中,①②两种操作生成的CO2体积之比为3:2
D.将等质量的Na2O和Na2O2样品分别放入等量的水中,所得溶液的质量分数分别为a%和b%,则a、b的关系是a=b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,另含少量杂质FeCO3和SiO2等)为原料制备高纯氧化镁的实验流程如下:
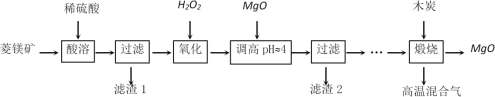
(1)酸溶时,MgCO3与稀硫酸反应的离子方程式为_____________________________。
(2)滤渣1的化学式为__________________。
(3)写出流程中“氧化”的离子方程式为______________________________________。
(4)调节pH时,使用pH试纸的具体操作是取一小块pH试纸放在洁净的玻璃片上,_______________________________________________________;滤渣2中除了过量的MgO外,还含有的物质是____________。
(5)高温煅烧过程中,同时存在以下反应:2MgSO4+C![]() 2MgO+2SO2↑+CO2↑;MgSO4+C
2MgO+2SO2↑+CO2↑;MgSO4+C![]() MgO+SO2↑+CO↑;MgSO4+3C高温MgO+S↑+3CO↑。利用下图装置对煅烧产生的气体进行连续分别吸收或收集(其中S蒸气在A管中沉积)。
MgO+SO2↑+CO↑;MgSO4+3C高温MgO+S↑+3CO↑。利用下图装置对煅烧产生的气体进行连续分别吸收或收集(其中S蒸气在A管中沉积)。
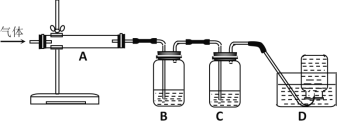
①D中收集的气体是_________________(填化学式)。
②B中盛放的溶液是__________________(填下列选项的字母编号)。
a.NaOH溶液 b.Na2CO3溶液 c.稀硝酸 d.酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用软锰矿[主要成分MnO2,还含SiO2 、Fe2O3、Al2O3、Cu2(OH)2CO3的等杂质]和酸洗厂废酸液(含1mol/LH2SO4的FeSO4溶液)联合生产硫酸锰和铁红(Fe2O3)生产过程如下

Mn(OH)2 | Fe(OH)2 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | |
开始沉淀时 | 8.3 | 6.3 | 4.7 | 3.4 | 2.7 |
完全沉淀时 | 9.8 | 8.3 | 6.7 | 4.4 | 3.2 |
(1)含杂质的软锰矿使用前需将其粉碎,目的是______。
(2)滤渣1中含有的主要物质是_______。
(3)滤液1中,加氨水调控溶液pH至3.2,通入O2,反应的离子方程式是_______。若用H2O2代替O2,是否合理?理由是___________。
(4)软锰矿粉与硫酸和硫酸亚铁溶液反应的离子方程式是_________。
(5)滤液3中加入难溶电解质MnS的目的是(用离子方程式表示)_________。
(6)用重结晶法从滤液4中获取硫酸锰晶体的操作是:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com