
【题目】A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应。
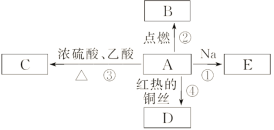
(1)写出A的结构简式:______________________,其官能团名称为__________。
(2)下列反应的化学方程式:
反应①:____________________________________________;
反应③:___________________________________________;
【答案】C2H5OH 羟基 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ CH3COOH+CH3CH2OH ![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
【解析】
A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,能与红热的铜丝反应得到D,能与Na反应,能与乙酸反应,A含有羟基,故A为C2H5OH,则C为CH3COOCH2CH3,D为CH3CHO,C2H5OH燃烧生成二氧化碳与水,C2H5OH与Na反应生成CH3CH2ONa与氢气,据此解答。
A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,能与红热的铜丝反应得到D,能与Na反应,能与乙酸反应,A含有羟基,故A为C2H5OH,则C为CH3COOCH2CH3,D为CH3CHO,C2H5OH燃烧生成二氧化碳与水,C2H5OH与Na反应生成CH3CH2ONa与氢气;
(1)A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,乙醇催化氧化生成乙醛,由上述分析可以知道,A为乙醇,结构简式为:C2H5OH;官能团为羟基;
故答案是:C2H5OH;羟基;
(2)乙醇与钠反应生成乙醇钠和氢气,反应方程式:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;乙酸和乙醇在浓硫酸作用下加热生成乙酸乙酯和水,反应的化学方程式为:CH3COOH+CH3CH2OH ![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
答案是:CH3COOH+CH3CH2OH ![]() CH3COOCH2CH3+H2O。
CH3COOCH2CH3+H2O。


科目:高中化学 来源: 题型:
【题目】25℃时,向0.10mol·L-1的H2C2O4(二元弱酸)溶液中滴加NaOH溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法不正确的是

A. 25℃时H2C2O4的一级电离常数为Ka1=104.3
B. pH=2.7的溶液中:c(H2C2O4)=c(C2O42-)
C. pH=7的溶液中:c(Na+)>2c(C2O42-)
D. 滴加NaOH溶液的过程中始终存在:c(OH-)+2c(C2O42-)+c(HC2O4-)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置。
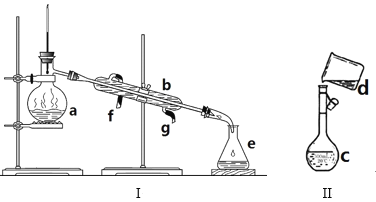
(1)写出下列仪器的名称:a、_____b、 _____
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是____,将仪器补充完整后进行实验,温度计水银球的位置在____处。冷凝水由____(填f或g)口通入,___口流出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家借助自主研制的新型钨钴铁合金催化剂攻克了可控结构单壁碳纳米管的制备难题。海底金属软泥是在海洋底覆盖着的一层红棕色沉积物,蕴藏着大量的金属资源,含有钨、铁、锰、锌、钴等。
(1)基态铬原子的核外未成对电子数为________。单壁碳纳米管可看作石墨烯沿一定方向卷曲而成的空心圆柱体,其碳原子的杂化方式为________。
(2)纳米结构氧化钴可在室温下将甲硫醛![]() 完全催化氧化,甲硫醛分子的中心原子的VSEPR构型为________,其分子中
完全催化氧化,甲硫醛分子的中心原子的VSEPR构型为________,其分子中![]() 键与
键与![]() 键的个数比为________。
键的个数比为________。
(3)六羰基钨![]() 的熔点为
的熔点为![]() ,是一种重要的无机金属配合物,可溶于多数有机溶剂。三种组成元素的第一电离能由小到大的顺序为________
,是一种重要的无机金属配合物,可溶于多数有机溶剂。三种组成元素的第一电离能由小到大的顺序为________![]() 填元素符号
填元素符号![]() 。配体CO中与W形成配位键的原子是C非O,原因是________________________。
。配体CO中与W形成配位键的原子是C非O,原因是________________________。
(4)多原子分子中各原子若在同一平面内,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域![]() 键”。下列分子中存在“离域
键”。下列分子中存在“离域![]() 键”的有________
键”的有________![]() 填字母
填字母![]() 。
。
A.环己烷 ![]() 二氧化硫
二氧化硫 ![]() 三氟化氮
三氟化氮 ![]() 苯酚
苯酚
(5)![]() 、
、![]() 能与
能与![]() 络合形成络离子,其结构如图1所示。该络离子与钾离子可形成华蓝钾盐,该钾盐的化学式为________。
络合形成络离子,其结构如图1所示。该络离子与钾离子可形成华蓝钾盐,该钾盐的化学式为________。
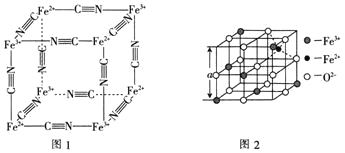
(6)图2是从铁氧体离子晶体![]() 中取出的能体现其晶体结构的一个立方体。已知
中取出的能体现其晶体结构的一个立方体。已知![]() 晶体的密度为
晶体的密度为![]() ,则图2中
,则图2中![]() ________
________![]() 已知
已知![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)据科技日报网报道,南开大学科研团队借助镍和苯基硼酸共催化剂,首次实现烯丙醇高效、绿色合成。烯丙醇及其化合物可制成甘油、医药、农药、香料,合成维生素E和KI及天然抗癌药物紫杉醇中都含有关键的烯丙醇结构。丙烯醇的结构简式为CH2=CH-CH2OH。请回答下列问题:
①基态镍原子的价电子排布图为________。
②1 mol CH2=CH-CH2OH含有σ键的数目为________,烯丙醇分子中碳原子的杂化类型为___。
③Ni2+能形成多种配离子,如[Ni(NH3)6]2+、[Ni(CN)2]2- 和[Ni(SCN)2]- 等,与CN-互为等电子体的阴离子为_____。
(2)乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
①CaC2中C22-中碳与碳之间存在碳碳三键,C22-与O22+互为等电子体,O22+的电子式可表示为_______。
②乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中σ键和π键数目比是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A.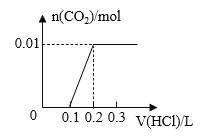 B.
B.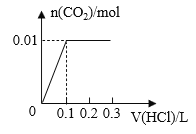
C.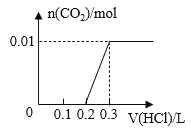 D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可燃冰主要含有甲烷水合物(CH4·nH2O),还含少量CO2等物质。
(1)可燃冰中,CH4分子的空间构型为_______,CO2的电子式为________
(2)工业利用甲烷制氢气,化学方程式为CH4(g) + H2O(g)CO(g) + 3H2(g)
①下列措施能加快反应速率的是_______
a.降低温度 b.增加CH4浓度 c.使用催化剂
②若上述反应在恒容的密闭容器中进行,下列叙述中能说明该反应已达平衡状态的是______
a.c(H2) = 3c(H2O) b.混合气体的质量不再变化 c.单位时间内生成1 mol CO,同时消耗3 mol H2
(3)某种甲烷燃料电池工作原理如图所示:
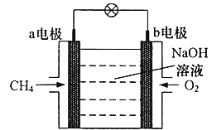
①电子移动方向为________,(填“a→b"或“b→a")
②b电极的电极反应式为____________。
(4)甲烷可催化还原NO,反应历程如图所示:

①该历程中,反应i为CH4+ 12Fe2O3=8Fe3O4+CO2+2H2O,
则反应ii的化学方程式为____________
②工业上催化还原2molNO,理论上需要______LCH4 (标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在体积可变的容器中发生反应:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(l),改变起始时加入各物质的量,在不同压强下达平衡时CH3OCH3(g)的物质的量如表所示,下列说法错误的是( )
CH3OCH3(g)+3H2O(l),改变起始时加入各物质的量,在不同压强下达平衡时CH3OCH3(g)的物质的量如表所示,下列说法错误的是( )
压强 | P1 | P2 | P3 | |
n/mol | ①2.0molCO2 6.0molH2 | 0.10mol | 0.04mol | 0.02mol |
②1.0molCO2 3.0molH2 | x 1 | y 1 | z 1 | |
③1.0molCH3OCH3 3.0molH2O | x 2 | y 2 | z 2 | |
A.P1>P2B.x 1=0.05
C.P2条件下,③中CH3OCH3平衡转化率为96%D.若该反应可自发进行,则高温更有利
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在铜、锌、稀硫酸构成的原电池中(如图所示)
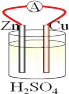
(1)负极是__________(填“铜”或“锌”),_________电子(填“失去”或“得到”),发__________(填“氧化”或 “还原”),电极反应方程式______________;
(2)电流由__________流向__________(填“铜”或“锌),铜片上观察到的现象是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com