
| A、滴入甲基橙显红色的溶液中:K+、Al3+、I-、ClO-、NO3- |
| B、常温下,某溶液pH=1的溶液中含有:NO3-、NH4+、Fe2+、SO42- |
| C、常温下,c(H+)/c(OH-)=1×10-12的溶液:K+、AlO2-、CO32-、Na+ |
| D、0.1mol/LFeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
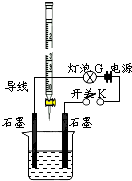 常温下,水的离子积Kw=1×10-14.有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.
常温下,水的离子积Kw=1×10-14.有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应速率HCl>CH3COOH |
| B、气泡逸出速率CH3COOH>HCl |
| C、在相同条件下两酸产生的CO2的体积不相同 |
| D、如果两酸的c(H+)相同时,两酸的物质的量浓度HCl>CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、②④ | C、③⑤ | D、②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜片做负极发生氧化反应 |
| B、锌片做负极发生氧化反应 |
| C、铜片做阳极发生还原反应 |
| D、锌片做阴极发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol H2SO4与1 mol Ba(OH)2完全中和所放出的热量为中和热 |
| B、由C(石墨)→C(金刚石)△H=+119 kJ?mol-1可知,石墨比金刚石稳定 |
| C、在101 kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=+285.8 kJ?mol-1 |
| D、在101 kPa,298 K条件下,1 mol S和2 mol S的燃烧产生的热量不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定条件下,水由气态变为液态 |
| B、2H2(g)+O2(g)═2H2O(g) |
| C、HCl(g)+NH3(g)═NH4Cl(s) |
| D、NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1摩尔水的质量 |
| B、1摩尔水蒸气的质量 |
| C、1摩尔水的体积 |
| D、1摩尔水蒸气的体积 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com