
����Ŀ������������H2C2O4��ʾ��Ϊ�˲ⶨij������Һ��Ũ�ȣ���������ʵ�飺��ȡWg���ᾧ�壬���100.00mLˮ��Һ��ȡ25.00mL�����ƵIJ�����Һ������ƿ�ڣ���������ϡH2SO4����Ũ��ΪamolL��1��KMnO4��Һ�ζ���KMnO4������ɫΪֹ���������ķ�ӦΪ��2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2��+2MnSO4+8H2O��
�Իش�
��1��ʵ���У���ҺKMnO4��ҺӦװ��ʽ�ζ����У���Ϊ ��
��2��ʵ�����۾�ע�� �� ֱ���ζ��յ㣮�жϵ����յ�������� ��
��3��ʵ���У����в�����������������ȷ��������������Ũ����ʲôӰ�죿����ƫ��ƫС����Ӱ�죩
A. �ζ�ǰ���ӿ̶ȣ��ζ����ӿ̶� ��
B. ��ƿ��ʢ�Ŵ���Һǰδ�������������ˮ ��
C. �ζ�������ҡ����ƿ��������ƿ�ڵ���Һ����һ���� ��
���𰸡�
��1���������ؾ���ǿ������
��2����ƿ����ɫ�仯����ƿ����Һ��ɫǡ������ɫ��Ϊ�Ϻ�ɫ���Ұ��������ɫ���ָ�
��3��ƫС����Ӱ�죻ƫС
����������1�����������Һ��ǿ�����ԣ�Ӧʢװ����ʽ�ζ����У���2���ζ�ʱ�����ֿ��ƻ���������ҡ����ƿ���۾���ƿ����ɫ�仯���ж��յ㣺�����һ�μ���ʱ����ƿ����Һ��ɫǡ������ɫ��Ϊ�Ϻ�ɫ���Ұ��������ɫ���ָ�����3������ ![]() ������֪��A.�ζ�ǰ���ӿ̶ȣ��ζ����ӿ̶ȵ���V(��)��С����c(����)ƫС��B. ��ƿ��ʢ�Ŵ���Һǰδ�������������ˮ����c(����)��Ӱ�죻C. �ζ�������ҡ����ƿ��������ƿ�ڵ���Һ����һ���֣�����n(H2C2O4)��С����ζ�����n(KMnO4)��С����V(��)��С����c(����)ƫС��
������֪��A.�ζ�ǰ���ӿ̶ȣ��ζ����ӿ̶ȵ���V(��)��С����c(����)ƫС��B. ��ƿ��ʢ�Ŵ���Һǰδ�������������ˮ����c(����)��Ӱ�죻C. �ζ�������ҡ����ƿ��������ƿ�ڵ���Һ����һ���֣�����n(H2C2O4)��С����ζ�����n(KMnO4)��С����V(��)��С����c(����)ƫС��
�����㾫����������Ĺؼ�������������к͵ζ������֪ʶ�������к͵ζ�ʵ��ʱ��������ˮϴ���ĵζ������ñ�Һ��ϴ����װ��Һ�����ô���Һ��ϴ������ȡҺ�壻�ζ��ܶ���ʱ�ȵ�һ�����Ӻ��ٶ������۲���ƿ����Һ��ɫ�ĸı�ʱ���ȵȰ������ɫ�����Ϊ�ζ��յ㣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���� (����)
A. HF���ȶ��Ժ�ǿ������ΪHF����֮�����γ����
B. ˮ��ɱ�ʱ��H��O���ļ����䳤���ܶȼ�С
C. ����Ԫ�صĻ�������һ�������
D. ����ˮ�����������������������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯�����ڹ�ũҵ����������������ҪӦ�ã����ٵ����������ڴ����е��ŷ��ǻ�����������Ҫ����֮һ��
��1����֪:N2(g)+O2(g)==2NO(g) ��H =+180.5kJ��mol-1
C(s)+O2(g)=CO2(g) ��H =-393.5kJ��mol-1
2C(s)+O2(g)=2CO(g) ��H =-221kJ��mol-1
��ij��Ӧ��ƽ�ⳣ������ʽΪ��k=[c(N2)��c2(CO2)]/[c2(NO)��c(CO)]����д���˷�Ӧ���Ȼ�ѧ����ʽ_______��
��2��N2O5��һ�������¿ɷ����ֽ�:2N2O5(g)![]() 4NO2(g)+O2(g)��ij�¶��²�ú����ܱ�������N2O5Ũ����ʱ��ı仯���:
4NO2(g)+O2(g)��ij�¶��²�ú����ܱ�������N2O5Ũ����ʱ��ı仯���:
t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
C(N2O6)/(mol/L) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
�ٷ�Ӧ��ʼʱ��ϵѹǿΪP0����3.00 minʱ��ϵѹǿΪP1����P1:P0=_______��2min~5.00min �ڣ�O2 �� ƽ ����Ӧ����Ϊ_____________��
��һ���¶��£��ں����ܱ������г���һ����N2O5���и÷�Ӧ�����жϷ�Ӧ�Ѵﵽ��ѧƽ��״̬����___��
a.NO2 ��O2 ��Ũ�ȱȱ��ֲ��� b.������ѹǿ���ٱ仯
c.2v��(NO2)= v��(N2 O5 ) d.�����ƽ����Է�������Ϊ43.2���ұ��ֲ���
��3����2molN2 ��4mo1H2 ����lL�ĺ����ܱ������з�Ӧ����ò�ͬ�¶ȡ���ͬʱ����ںϳ�NH3 ��Ӧ��N2 ��ת���ʣ��õ��������±�:

����a��b��25%�����ɴ�С��˳��Ϊ_____��������_____��
��4������3����ʵ��õ��Ļ������ͨ�������Һ�в��ָ���25�棬������ǡ�÷�Ӧʱ�����ɵ�CH3COONH4��Һ�����ԣ���25��ʱNH3��H2O�ĵ���ƽ�ⳣ��Kb=______(��֪:25��ʱ0.18mol/LCH3COOH ��Һ��c(H+)=1.8��10-3mol/L)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���⼰�仯����������������ͿƼ��ȷ��涼������Ҫ��Ӧ�á��ش��������⣺
��1����֪����2I2(s)+5O2(g)��2I2O5(s) ��H����1966 kJmol-1
��2CO(g)+O2(g)��2CO2(g) ��H����1200 kJmol-1 ��
��5CO��g��+I2O5(s)=5CO2(g)+I2��s���ġ�H= __________________________��
��2���ⲻ������ˮ���������ڵ⻯����Һ�����ɶ�����ӣ���Ӧ���£�
�� I2(s)+I-(aq)![]() I3-(aq) ��H<0�� �� I2 (s)+2I-(aq)
I3-(aq) ��H<0�� �� I2 (s)+2I-(aq)![]() I42-(aq)��
I42-(aq)��
�¶Ƚ���ʱ����Ӧ�ٵ�ƽ�ⳣ����______________(�������С�����䡱)����Ӧ�ڵ�ƽ�ⳣ���ı���ʽΪK=__________________________��
��3����������һ���¶��£��ɷ������¿��淴Ӧ��W(s)+I2(g)![]() WI2(g)����ȷ��ȡ0.508g���0.736g�����ٷ�����50.0mL���ܱ������У�������ʹ�䷴Ӧ����ͼ�ǻ�������е�WI2���������ʵ�����ʱ��仯��ϵ��ͼ��[n(WI2)��t]���������ߢ�(0��t2ʱ���)�ķ�Ӧ�¶�Ϊ450�棬���ߢ�(��t2ʱ�̿�ʼ)�ķ�Ӧ�¶�Ϊ530�档
WI2(g)����ȷ��ȡ0.508g���0.736g�����ٷ�����50.0mL���ܱ������У�������ʹ�䷴Ӧ����ͼ�ǻ�������е�WI2���������ʵ�����ʱ��仯��ϵ��ͼ��[n(WI2)��t]���������ߢ�(0��t2ʱ���)�ķ�Ӧ�¶�Ϊ450�棬���ߢ�(��t2ʱ�̿�ʼ)�ķ�Ӧ�¶�Ϊ530�档
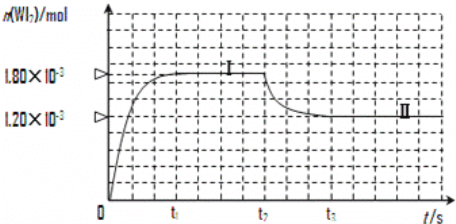
�� �÷�Ӧ��H____________0(�>����<��)��
�� ��Ӧ�ӿ�ʼ��t1(t1= 3 min)ʱ���� I2 ��ƽ����Ӧ����v(I2)=_________��
�� ��450��ʱ���÷�Ӧ��ƽ�ⳣ��K��ֵΪ__________________��
�� �ܹ�˵��������Ӧ�Ѿ��ﵽƽ��״̬����________________ (��ѡ����ĸ)��
A.I2��WI2��Ũ����� B. �����ڸ������Ũ�Ȳ��ٸı�
C. �����ڻ��������ܶȲ��ٸı� D.����������ѹǿ�������仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֶ�����Ԫ��X��Y��Z��M��W��ԭ���������䳣�����ϼ۵Ĺ�ϵ��ͼ��ʾ�����й�ϵ����ȷ���ǣ� ��
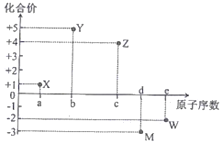
A. Ԫ��X����Ϊ�
B. ԭ�Ӱ뾶��С��r(M)��r(w)
C. X2W�и�ԭ�Ӿ���8�����ȶ��ṹ
D. Ԫ����̬�⻯��ķе㣺YH3��MH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯�У�����Ҫ�ƻ���ѧ�����ǣ� ��
A.�Ȼ�������ˮ
B.����ʹ���ڻ�
C.����ʹ����þ�ۻ�
D.�Ȼ�������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ʊ���������泥�NH2COONH4���ķ�Ӧ���£�2NH3(g)��CO2(g)![]() NH2COONH4(s)���÷�Ӧ�ڸ��������½����ɰ�������泥�����ˮ����������̼��炙�̼����李�
NH2COONH4(s)���÷�Ӧ�ڸ��������½����ɰ�������泥�����ˮ����������̼��炙�̼����李�
��1���÷�Ӧ��һ���������ܹ��Է����У���Ӧ�Ħ�H________0��������ڡ�С�ڻ���ڣ�
��2��д������̼����淋Ļ�ѧ����ʽ________��
��3��ʵ�鲽�����£�
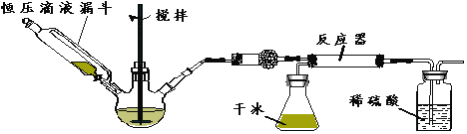
����1����ͼ��ʾ��װ���������װ�������ԡ�
����2������Ӧ������װ��ҩƷ��������������ƿ�м����������ƹ��壬��ѹ��Һ©����װ��Ũ��ˮ��
����3���μ�Ũ��ˮ�����裬���ڷ�Ӧ���ʣ��ڷ�Ӧ���еõ���Ʒ
����
�ٸ������ʢ�ŵ�ҩƷ��_________��
�ڶԱ�̼���κ��ᷴӦ��CO2����ʵ�����øɱ���������CO2������ŵ���______��_______��
���Ժ�ѹ��Һ©�������Һ©����Ŀ����________________��
�ܷ�Ӧ����CO2�������½�ʱ���ɲ�ȡ����Ӧ��ʩ��______________��
��4����ʵ��װ���п��ܴ��ڵ�ȱ����____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����( )
A. ���Ӿ��岻һ�������н���Ԫ��
B. ���Ӿ����г������Ӽ��⣬�����ܺ���������ѧ��
C. ����Ԫ����ǽ���Ԫ�ع��ɵľ��岻һ�������Ӿ���
D. �ۻ����ܵ���ľ���һ�������Ӿ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.����C919���Ϳͻ�����ʽ���ߣ���־���ҹ����չ�ҵ�������µķ�չ�����ҹ���Ϊ�������������������������ƴ��ͷɻ��Ĺ���֮һ��
��1���ɻ������ͨ������þһ���Ͻ���ϣ����ļ۵����Ų�ͼΪ_______________����һ����������________������ڡ���С�ڡ���þ��
��2��Ϊ�˼�����������������dz�ѹ�������ִ��ɻ�ͨ�����ø��ϲ���һ������ά��ǿ���ϣ���ɷ�֮һΪ������֬��������E51�ͻ�����֬�в��ֽṹ��ͼ����ʾ������̼ԭ�ӵ��ӻ���ʽΪ___________���ò��ϴ˲���������Ԫ�صĵ縺�Դ�С�����˳��Ϊ_______________��

II�����ͷɻ��ķ����������������ͨ������̼�������ؼ���λ�IJ�����
��1����Ԫ��λ�����ڱ��ĵ������ڵ�VIB�壬��д����λ��ͬһ���Ԫ�ظ���ԭ�ӵļ۵����Ų�ʽ__________________��
��2��ͼ��Ϊ̼���پ����һ���ֽṹ��̼ԭ��Ƕ������ٵľ���ļ�϶�������ƻ�ԭ�н����ľ����γ���϶+�����壬Ҳ��Ϊ��϶���������ڴ˽ṹ�У�������ԭ����_______����1����ԭ����Χ������ԭ�������̼ԭ����_______�������н���Ԫ�صĶѻ���ʽ��̼���پ�����̼ԭ�Ӻ���ԭ������λ�����Ƶ���___________������ţ���
A.Fe Cu B.Ti Au C.Mg Zn D.Cu Ag
��4����ò��־�������ΪVcm3��̼���ٵ�Ħ������ΪM g/mol���ܶ�Ϊb g/cm3�����ӵ�����NA���������ݿ��Ա�ʾΪ____________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com