
 |  |  | … |
| 1 | 2 | 3 | … |
| A、C53H108 |
| B、C36H72 |
| C、C53H106 |
| D、C36H70 |
 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba2+一定存在 |
| B、100mL该溶液中含0.01mol HCO3- |
| C、Na+不一定存在 |
| D、Cl-不确定,可向原溶液中加入AgNO3溶液进行检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ag和AgCl溶液 |
| B、Ag和AgNO3溶液 |
| C、Pt和Ag2CO3溶液 |
| D、Pt和Ag2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解稀硫酸溶液,实质上是电解水,故溶液pH不变 |
| B、电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小 |
| C、电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为2:1 |
| D、电解氯化铜溶液,在阴极上和阳极上析出产物的质量之比为71:64 |
查看答案和解析>>
科目:高中化学 来源: 题型:
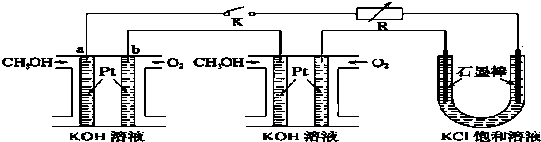
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
A、反应在t1 min内的平均速率为v(H2)=
| ||
| B、保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.30 mol | ||
| C、保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大 | ||
| D、温度升高至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com